
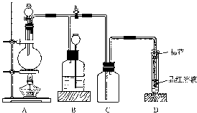
 如图所示装置为铜跟浓硫酸反应制取二氧化硫的实验装置:
如图所示装置为铜跟浓硫酸反应制取二氧化硫的实验装置:分析 (1)通过微热A装置,根据D导管中是否产生气泡及关闭K时长颈漏斗中液面是否变化检验装置气密性;
(2)加热条件下,Cu和浓硫酸发生氧化还原反应生成二氧化硫、硫酸铜和水;
(3)二氧化硫属于酸性氧化物,且有毒,不能排入空气中,应该用碱液吸收;
(4)B中盛放的液体不能和二氧化硫反应,为防止二氧化硫排放污染空气,需要在装置B中储存气体.
解答 解:Ⅰ.(1)气密性检验操作方法及现象为将D装置中导管口浸没在水面下,关闭分液漏斗活塞,打开K,微热A装置,D的导管口有气泡冒出;关闭K,长颈漏斗中液面上升(B瓶中液面下降),说明装置不漏气,
故答案为:将D装置中导管口浸没在水面下,关闭分液漏斗活塞,打开K,微热A装置,D的导管口有气泡冒出;关闭K,长颈漏斗中液面上升(B瓶中液面下降),说明装置不漏气;
(2)加热条件下,Cu和浓硫酸发生氧化还原反应生成二氧化硫、硫酸铜和水,反应方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(3)二氧化硫属于酸性氧化物,且有毒,不能排入空气中,否则会污染大气,应该用碱液吸收,所以D中液体是碱液,目的是吸收多余的二氧化硫,
故答案为:碱液;吸收多余的SO2;
(4)B装置的作用是贮存多余的二氧化硫和防止其污染环境,则二氧化硫和该物质不能反应,二氧化硫具有还原性,能溶于水生成亚硫酸,能被强氧化剂溴、酸性高锰酸钾溶液氧化,和亚硫酸氢钠不反应,故选d;为防止二氧化硫排放污染空气,收集二氧化硫完毕,为防倒吸,应进行的操作关闭活塞K,撤去酒精灯.
故答案为:d;关闭活塞K,撤去酒精灯.
点评 本题以Cu和浓硫酸反应为载体考查性质实验方案设计及实验方案评价,侧重考查实验基本操作、物质的性质等知识点,明确实验原理及物质的性质是解本题关键,知道装置中各个装置的作用及可能发生的反应,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 过氧化氢分解制得标准状况下1.12 L O2,转移电子数目为 0.2 NA | |
| B. | 1mol Na2CO3晶体中含CO32-离子数小于NA | |
| C. | 惰性电极电解食盐水,若线路中通过NA个电子,则阳极产生气体标况下11.2L | |
| D. | 0.1mol的CaO2中含阴离子数是0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol聚乙烯含有的原子数目为6NA | |
| B. | 标准状况下,11.2L CHCl3中所含有的原子总数为2.5NA | |
| C. | 一定条件下,2.6 g乙炔、苯和苯乙烯的气态混合物中所含碳原子数为0.2NA | |
| D. | 1 mol甲基含10 NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 弱酸化学式 | HClO | H2CO3 |
| 电离平衡常数 | 4.7×10-8 | K1=4.3×10-7 K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | LiAlH4与乙醛作用生成乙醇,LiAlH4作还原剂 | |
| B. | LiAlH4与D2O反应,所得氢气的摩尔质量为4 g•mol-1 | |
| C. | 1 mol LiAlH4在125℃完全分解,转移3 mol电子 | |
| D. | LiAlH4与水反应生成三种物质时,化学方程式可表示为:LiAlH4+4H2O═Al(OH)3↓+LiOH+4H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上可利用空气冷冻成液体后再分离来获得液氧 | |
| B. | 煤油燃烧后的主要产物是水和二氧化碳,绿色环保 | |
| C. | 煤油属于纯净物.主要成分是烃 | |
| D. | 火箭装载的燃料越多,说明其动力越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等浓度NaCN、Na2CO3溶液,pH值:前者>后者 | |
| B. | NaCN溶液中通入少量CO2的离子方程式:2CN-+CO2+H2O=CO32-+2HCN | |
| C. | pH=12的NaOH溶液与pH=5HCN溶液等体积混合后恰好中和,混合后c(Na+)=c(CN-) | |
| D. | 若pH=12的NaOH溶液与pH=5HCN溶液混合后pH=7,则由水电离c(H+)=10-7mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com