
【题目】把13g Zn放入足量的盐酸中,Zn完全反应。计算:
(1)13g Zn的物质的量___________
(2)参加反应的HCl的物质的量___________
(3)生成H2的体积(标准状况)___________
科目:高中化学 来源: 题型:
【题目】室温下向10mL0.1molL-1NaOH溶液中加入0.1molL-1的一元酸HA溶液pH的变化曲线如图所示。下列说法正确的是( )

A. a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA) B. a、b两点所示溶液中水的电离程度相同
C. pH=7时,c(Na+)=c(A-)+c(HA) D. b点所示溶液中c(A-)>c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据《朝闻天下》报道,河南驻马店发现特大天然碱,铅锌矿产资源。
试回答下列问题:
(1)在元素周期表中,铅与锗同主族,铅的周期数比锗大2。基态铅原子的价层电子排布式____,有_____个未成对电子。
(2)镓与锌同周期,原子序数比锌大1,锌的第一电离能大于镓的第一电离能。其原因是_____。
(3)天然碱的化学式Na2CO3·NaHCO3·2H2O。CO32-的立体构型是________;H2O中O原子采取______杂化。
(4)金是贵重金属。冶企工业上,提取企的原理是2[Au(CN)2]+ Zn=2Au+[Zn(CN)4]2-。
①与CN-互为等电子体的离子有______(任写一种); HCN分子中σ键与π键数目之比为______。
②[Zn(CN)4]2-的配体是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物F(Bisphenol A dimethacrylate)是一种交联单体。合成F的一种路线如下:
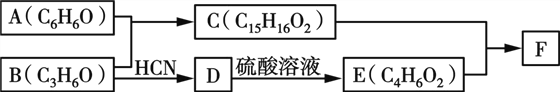
已知:
①![]() +HCN
+HCN![]()
②B不能发生银镜反应。
③C能与FeCl3发生显色反应,核磁共振氢谱显示有4种不同化学环境的氢。
④E既能使溴水褪色又能使石蕊试液显红色。
⑤1 mol F最多可与4 mol NaOH反应。
回答下列问题:
(1)A与B反应的化学方程式为________________。
(2)B→D的反应类型为____,E的结构简式为________。
(3)F的结构简式为____________。
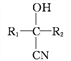
(4)C的同分异构体中含有萘环(![]() )结构,萘环上只有1个取代基且水解产物之一能与FeCl3溶液发生显色反应的同分异构体共有____种(不考虑立体异构),其中核磁共振氢谱有8组峰的是____________(写出其中一种的结构简式)。
)结构,萘环上只有1个取代基且水解产物之一能与FeCl3溶液发生显色反应的同分异构体共有____种(不考虑立体异构),其中核磁共振氢谱有8组峰的是____________(写出其中一种的结构简式)。
(5)A经如下步骤可合成环己烯甲酸:
A![]() G
G![]() H
H![]() I
I![]()
![]()
反应条件1为________;反应条件2为______;反应条件3所选择的试剂为____;I的结构简式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如下图装置实验,下列实验现象预期及相应结论均正确的是
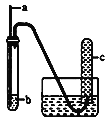
a | b | 实验现象预期 | 结论 | |
A | 铁丝 | HCl酸化的H2O2 | c中收集到无色气体 | 铁丝催化H2O2分解 |
B | 铜丝 | 浓硝酸 | c中收集到红棕色气体 | 硝酸有强氧化性 |
C | 生铁 | NaCl溶液 | 导管处发生倒吸 | 生铁发生吸氧腐蚀 |
D | 木条 | 浓硫酸 | 木条变黑 | 浓硫酸有强氧化性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废气、汽车尾气排放出的NOx、SO2等,是形成雾霾的主要物质,其综合治理是当前重要的研究课题。
Ⅰ. NOx的消除。汽车尾气中的NO(g)和CO(g)在一定温度和催化剂条件下可发生如下反应:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g) △H。
N2(g)+2CO2(g) △H。
(1)已知:CO燃烧热的△H1=-283.0kJ·mol-l,
N2(g)+O2(g) ![]() 2NO(g) △H2=+180.5kJ·mol-1,则△H=____________。
2NO(g) △H2=+180.5kJ·mol-1,则△H=____________。
(2)某研究小组探究催化剂对CO、NO转化的影响。将NO和CO以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中NO含量,从而确定尾气脱氮率(脱氮率即NO的转化率),结果如下图所示。
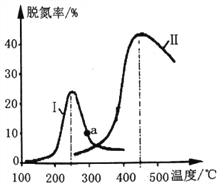
①以下说法正确的是__________________(填字母)。
A.两种催化剂均能降低活化能,但△H不变
B.相同条件下,改变压强对脱氮率没有影响
C.曲线Ⅱ中的催化剂适用于450℃左右脱氮
D.曲线Ⅱ中催化剂脱氮率比曲线I中的高
②若低于200℃,图中曲线I脱氮率随温度升高而变化不大的主要原因为___________;判断a点是否为对应温度下的平衡脱氮率,并说明其理由:____________。
Ⅱ.SO2的综合利用
(3)某研究小组对反应NO2+SO2![]() SO3+NO △H<0进行相关实验探究。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比[no(NO2):no(SO2)]进行多组实验(各次实验的温度可能相同,也可能不同),测定NO2的平衡转化率[a(NO2)]。部分实验结果如右图所示。
SO3+NO △H<0进行相关实验探究。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比[no(NO2):no(SO2)]进行多组实验(各次实验的温度可能相同,也可能不同),测定NO2的平衡转化率[a(NO2)]。部分实验结果如右图所示。
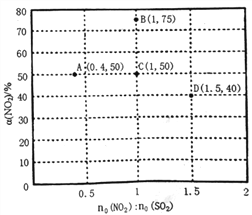
①如果将图中C点的平衡状态改变为B点的平衡状态,应采取的措施是________________。
②图中C、D两点对应的实验温度分别为TC和TD,通过计算判断:TC__________TD(填“>”、“=”或“<”)。
(4)已知25℃时,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。若氨水的浓度为2.0mol·L-1,溶液中的c(OHˉ)= ____________mol·L-1;将SO2通入该氨水中,当溶液呈中性时溶液中的![]() =__________。
=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素R、X、Y、Z的原子序数依次递增,R的无氧酸溶液能在玻璃容器上刻标记;R和X能形成XR3型化合物,X在化合物中只显一种化合价;R和Z位于同主族,Y原子最外层电子数等于电子层数的2倍。下列有关推断正确的是
A. R单质和Z单质均可与水发生反应置换出O2
B. 上述元素形成的简单离子都能促进水的电离平衡
C. YR6能在氧气中剧烈燃烧
D. 元素对应的简单离子的半径:Y>Z>R>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁铝合金投入100mL一定物质的量浓度的盐酸中,若合金全部溶解,向所得溶液中滴加10.0 mol/L NaOH溶液至过量,生成沉淀的质量与加入氢氧化钠溶液体积的关系如下图所示。

(1)当加入NaOH溶液80mL到90mL时,发生反应的离子方程式为:_______________________________。
(2)当沉淀达到最大值时,其中Al(OH)3的质量为______________g;
(3)原盐酸的物质的量浓度为_______________mol/L;
(4)若所取盐酸的体积和浓度均保持不变,为保证加入100mL 10.0 mol/L NaOH溶液时最终无 Al(OH)3生成,则此时所取合金中含Al的物质的量即n(Al)的取值范围为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,0.1mol·L-1的某一元酸HA在水中有0.1%发生电离,下列说法不正确的是
A.该溶液pH=4
B.由HA电离出的c(H+)约为水电离的c(H+)的106倍
C.此酸的电离平衡常数约为1×10-7
D.升高温度,溶液的pH增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com