
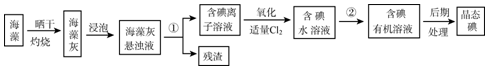
分析 海带晒干灼烧可生成水和二氧化碳,海带灰中含有碘化钾等物质,溶于水,浸泡过滤得到含有碘离子的溶液,加入氯水或通入氯气,氯气置换出碘,得到碘的水溶液,用四氯化碳萃取得到含碘的有机溶液,经蒸馏可得到碘,
(1)灼烧固体,应在坩埚中进行;
(2)海藻提取碘,将海藻灼烧成灰的目的是增加反应物接触面积或加速溶解,分离不溶性固体和溶液采用过滤的方法;
(3)分离固体和液体用过滤,将碘水转化为含碘的有机溶液,需用对卤素单质溶解能力强的有机溶剂把碘从碘水中提取出来,对应进行的实验操作是萃取;
(4)步骤②为分液操作;
(5)萃取的基本原则两种溶剂互不相溶,且溶质在一种溶剂中的溶解度比在另一种大的多,萃取剂与溶质不反应,据此来选择合适的试剂;
(6)四氯化碳的密度比水大;
(7)根据碘单质的特性遇淀粉显蓝色来检验.
解答 解:(1)灼烧固体,应在坩埚中进行,故答案为:坩埚;
(2)海藻中碘以I-形式存在,提取碘,将海藻灼烧成灰的目的是增加反应物接触面积或加速溶解,除去有机物,便于溶解,故答案为:A;
(3)分离固体和液体用过滤;利用溶质在互不相溶的溶剂里溶解度不同,用一种溶剂把溶质从它跟另一种溶剂所组成的溶液里提取出来,这种方法叫做萃取,将碘水中的碘单质萃取出来,选择合适的萃取剂即可,
故答案为:过滤;萃取(分液);
(4)步骤②为分液,一般在分液漏斗中进行,故答案为:分液漏斗;
(5)萃取的基本原则两种溶剂互不相溶,且溶质在一种溶剂中的溶解度比在另一种大的多,故可用汽油、四氯化碳或苯,与密度等无关,
故答案为:BC;
(6)静置后分层,四氯化碳为不溶于水比水重的有机溶剂,静置后分层,四氯化碳在下层为紫红色,
故答案为:紫红;
(7)淀粉溶液遇碘变蓝色,可用来检验碘单质,所以操作为取少量提取液于试管中,滴加淀粉溶液,若溶液显蓝色,则说明原提取液中有碘单质,
故答案为:取少量提取液于试管中,滴加淀粉溶液,若溶液显蓝色,则说明原提取液中有碘单质.
点评 本题考查制备实验方案的设计、实验室里从海藻中提取碘,为高频考点,侧重考查学生的分析能力和实验能力,涉及到的知识点较多,掌握碘元素的有关知识及其计算是解答的关键,题目难度中等,注意基本实验操作的要点和注意事项.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (CH3)3CCH2OH | B. | (CH3CH2)2CHOH | C. | CH3(CH2)2CH(CH3)OH | D. | CH3CH2C(CH3)2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1,2-二氯丙烷 | B. | 1,1-二氯丙烷 | C. | 1,3-二氯丙烷 | D. | 2,2-二氯丙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 属于置换反应 | B. | A1作还原剂 | ||
| C. | Fe2O3被还原 | D. | 该反应是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 | HVO3 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 | 难溶 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com