
| A. | CH3-CH=CH-CH3+Br2$→_{△}^{催化剂}$ | |
| B. | CH2=CH-CH2CH3+HCl | |
| C. | CH3-CH=CH2+H2O $→_{加热、加压}^{催化剂}$ | |
| D. | CH3CH3+Cl2$\stackrel{光照}{→}$ |
分析 A.2-丁烯结构对称,与溴只有一种加成方式;
B.1-丁烯结构不对称,与HCl存在两种加成方式;
C.丙烯结构不对称,与水存在两种加成方式;
D.光照下取代反应为链锁反应,产物复杂.
解答 解:A.2-丁烯结构对称,与溴只有一种加成方式,则只生成2,3-二溴丁烷,故A选;
B.1-丁烯结构不对称,与HCl存在两种加成方式,可生成1-氯丁烷或2-氯丁烷,故B不选;
C.丙烯结构不对称,与水存在两种加成方式,可生成1-丙醇或2-丙醇,故C不选;
D.光照下取代反应为链锁反应,产物复杂,可生成多种卤代烃,故D不选;
故选A.
点评 本题考查有机物的结构与性质,为高频考点,把握烯烃、烷烃的性质及有机反应、有机物结构对称性为解答的关键,侧重分析与应用能力的考查,注意取代反应的特点,题目难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 可逆反应的化学计量数数:a>b+c | |
| B. | 压缩容器的容积时,v正增大,v逆减小 | |
| C. | 达到新平衡时,Y,Z浓度增大,K值变大 | |
| D. | 达到新平衡时,加入物质X反应正动,X的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向碳酸钠溶液中加醋酸 CO32-+2H+═H2O+CO2↑ | |
| B. | 向稀硫酸溶液中投入铁粉 2Fe+6H+═2Fe3++3H2↑ | |
| C. | 向盐酸中投入碳酸钙 CO32-+2H+═H2O+CO2↑ | |
| D. | 硫酸氢钠溶液中加入氢氧化钡溶液至中性:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若温度不变将容器的容积增大1倍,达到新平衡时A的浓度变为原来的0.55 倍,则m+n<p+q | |
| B. | 若升高平衡体系的温度,达到新平衡时A 的浓度变为原来的0.55 倍,说明该反应△H<0 | |
| C. | 若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n | |
| D. | 若平衡后同时增大A、B的浓度,则A、B的转化率一定都减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | A | B | C |
| 装置 | 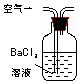 | 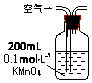 | 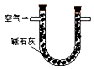 |
| 原理 | 通入V升空气,测定生成沉淀的质量 | 当KMnO4溶液刚好褪色时,测定通入空气的体积V | 通入V升空气,测定U型管增加的质量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com