
已知T℃时,CaCO3(s)=CaO(s)+CO2(g) △H=+177.70kJ·mol-1,则每生成28gCaO(s)时,吸收的热量为( )
A. 44.43KJ B.88.85KJ C. 133.28KJ D. 177.70kJ
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源:2017届吉林长春外国语学校高三上期末化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.滴入酚酞显红色的溶液:Na+、Fe3+、NO3-、Cl-
B.0.1 mol·L-1氨水溶液:K+、Na+、NO3-、AlO2-
C.0.1 mol·L-1 Fe(NO3)2溶液:H+、Al3+、SO42-、Cl-
D.水电离出的c(H+)浓度为10-12的溶液:Ca2+、NH4+、Cl-、HCO3-
查看答案和解析>>
科目:高中化学 来源:2017届北京市昌平区高三上学期期末化学试卷(解析版) 题型:选择题
利用如图所示装置进行下列实验,能得出相应实验结论的是
选项 | ① | ② | ③ | 实验结论 |
|
A | 浓盐酸 | Na2CO3 | Na2SiO3溶液 | 非金属性: C>Si | |
B | 食盐水 | 电石 | 溴水 | 乙炔可与溴发生加成反应 | |
C | 浓硝酸 | Al | NaOH溶液 | 铝和浓硝酸反应可生成NO2 | |
D | 浓硫酸 | Na2SO3 | KMnO4酸性溶液 | SO2具有还原性 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年吉林省长春市五县高二上期末化学试卷(解析版) 题型:填空题
只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能。请认真观察下图,然后回答相关问题。
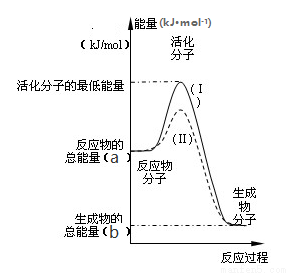
(1)图中所示反应是 (填“吸热”或“放热”)反应,该反应的反应热△H = (用含a、b的代数式表示)kJ·mol-1。
(2)对于同一反应,图中虚线Ⅱ与实线Ⅰ相比,活化能大大降低,活化分子百分数增多,反应速率加快,你认为最可能的原因是_________________________。
(3)已知热化学方程式:2NO2(g)= N2O4(g) △H = - 57.2kJ·mol-1,该反应的活化能为31.5kJ·mol-1,则其逆反应的活化能为____________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年吉林省长春市五县高二上期末化学试卷(解析版) 题型:选择题
下列有关0.10mol·L-1的NH4Cl溶液的叙述正确的是( )
A.c(H+)<c(OH-) B.c(NH4+)>c(Cl-)
C.c(NH4+)+c(H+)=c(Cl-)+c(OH-) D.c(NH4+)+c(Cl-)=0.10mol·L-1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年吉林省长春市五县高二上期末化学试卷(解析版) 题型:选择题
下列反应既属于氧化还原反应,又属于吸热反应的是( )
A.Na2O2与H2O反应 B.灼热的木炭与水蒸气反应
C.铝热反应 D.CH4与O2反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江、吉林省两省六校高一上期中化学试卷(解析版) 题型:选择题
反应3NO2+H2O=2HNO3+NO中,当有6mole-发生转移时,被氧化的物质与被还原的物质的量之比为( )
A.1∶1 B.1∶2 C.2∶1 D.3∶1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江、吉林省两省六校高一上期中化学试卷(解析版) 题型:选择题
下列对于“摩尔”的理解正确的是( )
A.摩尔是国际单位制的一个基本物理量
B.摩尔是物质的量的单位,简称摩,符号为mol
C.摩尔可以把物质的宏观数量与微观粒子的数量联系起来
D.表示6.02×1023个粒子 的集合体
的集合体
查看答案和解析>>
科目:高中化学 来源:2017届广东省高三上第二次段考化学试卷(解析版) 题型:填空题
氮及其化合物在生产生活中有广泛应用。
(1)已知:CO可将部分氮的氧化物还原为N2。
反应Ⅰ:2CO(g)+2NO(g) N2(g)+2CO2(g) △H = -746 kJ·mol-1
N2(g)+2CO2(g) △H = -746 kJ·mol-1
反应Ⅱ:4CO(g)+2NO2(g) N2(g)+4CO2(g) △H = -1200 kJ·mol-1
N2(g)+4CO2(g) △H = -1200 kJ·mol-1
写出CO将NO2还原为NO的热化学方程式 。
(2)在一绝热恒容的容器中充入2mol CO和1mol NO2发生上述反应II,以下能说明反应达到平衡状态的是 ( )
A.容器内的总压强不在变化 B.容器内CO和NO2物质的量比不变
C.容器内气体平均密度不变 D.容器内气体温度恒定不变
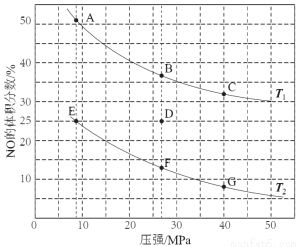
(3)在密闭容器中充入5 mol CO和4 mol NO发生上述反应I,下图为平衡时NO的体积分数与温度、压强的关系。
回答下列问题:
①温度:T1 T2(填“<”或“>” )。
②某温度下,在体积为2 L的密闭容器中,反应进行10分钟放出热量373 kJ,用CO的浓度变化表示的平均反应速率v(CO)= 。
③若在D点对反应容器升温的同时扩大体积使体系压强减小,重新达到的平衡状态可能是图中A~G点中的 点
(4)某温度时,亚硝酸银AgNO2的 Ksp= 9.0×10-4、Ag2SO4的Ksp=4.0×10-5,当向含NO2-、SO42-混合溶液中加入AgNO3溶液至SO42-恰好完全沉淀(即SO42-浓度等于1.0×10-5 mol·L-1)时,c(NO2-)= mol·L-1。
(5)如右图,在酸性条件下,电解水中CN-可转化为CO2和N2,请写出阳极的电极反应式 。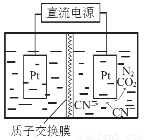
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com