
| |||||||||||||||||
(1) |
”÷H4£½£«7.28kJ”¤mol£1 |
(2) |
ĻņŹŌ¹ÜÖŠ¼ÓČė×ćĮæµÄÅØĻõĖį£¬½«ŹŌ¹ÜŠ±·Å£¬ŌŁ°ŃĶʬ·ÅŌŚŹŌ¹ÜÄŚ±Ś£¬Čū½ō½ŗČū£¬ĀżĀżµ½Ö±Į¢ŹŌ¹Ü£¬Ź¹ĶʬŃŲŹŌ¹ÜÄŚ±Ś»¬ĻĀ£¬ÓėÅØĻõĖį½Ó“„ |
(3) |
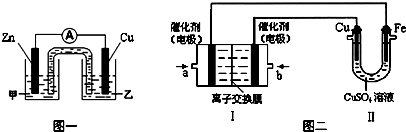
3Cu£«8H(NO3)3£½£½Cu(NO3)2£«2NO”ü£«4H2O £¬2NO£«O2£½£½2NO2) NaOH”¢NaNO3”¢NaNO2 |
(4) |
¼×£¬ŌŚĶعżCÖŠµÄĖ®Ź±£¬NOÖŠĖłŗ¬µÄNO2øśĖ®·“Ó¦£¬ÓÖ“ļµ½NO£¬ŌŁ¾DÖŠµÄÅØĮņĖįøÉŌļæÉ“ļµ½“æ¾»”¢øÉŌļµÄNO |



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
| 1 |
| 2 |
| 1 |
| 2 |
| a |
| 4 |
| a |
| 4 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŌĶĮĄķ½ā
| 1 |
| 2 |
| 1 |
| 2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
 £Ø1£©ĆĄ¹ś”°°¢ĢŲĄ¼µŁĖ¹ŗÅ”±ŗ½Ģģ·É»śÓė2009Äź5ŌĀ11ČÕÉżæÕŠŽø“ŗ¬²ŖĶūŌ¶¾µ£¬ĖüŹ¹ÓƵÄČ¼ĮĻŹĒŅŗĒāŗĶŅŗŃõ£®ŅŃÖŖĻĀĮŠČČ»Æѧ·½³ĢŹ½£ŗ
£Ø1£©ĆĄ¹ś”°°¢ĢŲĄ¼µŁĖ¹ŗÅ”±ŗ½Ģģ·É»śÓė2009Äź5ŌĀ11ČÕÉżæÕŠŽø“ŗ¬²ŖĶūŌ¶¾µ£¬ĖüŹ¹ÓƵÄČ¼ĮĻŹĒŅŗĒāŗĶŅŗŃõ£®ŅŃÖŖĻĀĮŠČČ»Æѧ·½³ĢŹ½£ŗ| 1 | 2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
| 1 |
| 2 |
| 1 |
| 2 |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com