
分析 反应生成气体为NO,NO与氧气混合通入水又生成HNO3,根据电子转移守恒计算NO物质的量,再根据V=nVm计算NO的体积;纵观整个过程,Fe失去电子等于氧气获得电子物质的量,根据电子转移守恒计算生成的盐中Fe元素化合价,可以确定生成的盐的化学式;根据氮元素守恒计算消耗的HNO3的物质的量.
解答 解:反应生成气体为NO,NO与氧气混合通入水又生成HNO3,通入氧气为$\frac{0.672L}{22.4L/mol}$=0.03mol,根据电子转移守恒,NO物质的量为$\frac{0.03mol×4}{5-2}$=0.04mol,则NO的体积为0.04mol×22.4L/mol=0.896L;
纵观整个过程,Fe失去电子等于氧气获得电子物质的量,Fe的物质的量为$\frac{2.8g}{56g/mol}$=0.05mol,根据电子转移守恒,生成的盐中Fe元素化合价为$\frac{0.03mol×4}{0.05mol}$=2.4,故盐中Fe元素化合价为+2、+3价,即生成Fe(NO3)2、Fe(NO3)3,设二者物质的量分别为xmol、ymol,则:$\left\{\begin{array}{l}{x+y=0.05}\\{2x+3y=0.03×4}\end{array}\right.$,解得x=0.03、y=0.02,
根据氮元素守恒,消耗的HNO3的物质的量=2n[Fe(NO3)2]+3n[Fe(NO3)3]+n(NO)=0.03mol×2+0.02mol×3+0.04mol=0.16mol,
故答案为:0.896;Fe(NO3)2、Fe(NO3)3;0.16mol.
点评 本题考查氧化还原反应有关计算,侧重考查学生分析计算能力,注意利用电子转移守恒与原子守恒解答.


科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
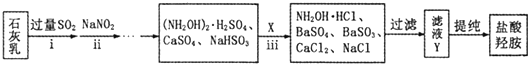
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HBr、HCl、HF | B. | CO2、NaCl、SiO2 | C. | I2、CO2、Hg | D. | Li、Na、K |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂水解后的产物经氧化为人体提供热能 | |
| B. | 油脂能溶解维生素A、D、E、K | |
| C. | 油脂能储备热能 | |
| D. | 多吃动物脂肪比多吃植物油好 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com