
【题目】下列物质既含离子键又含共价键的是( )
A. CaCl2 B. NH4Cl C. MgF2 D. H2O2
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】镁铝合金在碱性溶液中开始反应缓慢,后反应加快,经分析是氧化膜及微电池作用的结果。下列叙述正确的是( )
A. 微电池的负极是Mg B. 微电池的负极是Al
C. 铝的电极反应式为2H++2e-===H2↑ D. 镁的电极反应式为Mg-2e-===Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E代表前四周期原子序数依次增大的五种元素。A、D同主族且有两种常见化合物DA2和DA3;工业上电解熔融C2A3制取单质C;B、E除最外层均只有2个电子外,其余各层全充满,E位于元素周期表的ds区。回答下列问题:
(1)B、C中第一电离能较大的是___________(用元素符号填空),基态D原子价电子的轨道表达式为______。
(2)DA2分子的VSEPR模型是___________。
(3)实验测得C与氯元素形成化合物的实际组成为C2Cl6,其球棍模型如图所示。已知C2Cl6在加热时易升华,与过量的NaOH溶液反应可生成Na[C(OH)4]。
①C2Cl6属于______晶体(填晶体类型),其中C原子的杂化轨道类型为____杂化。

②[C(OH)4]-中存在的化学键有________。
⑷B、C的氟化物晶格能分别是2957 kJ·mol-1 、5492 kJ·mol-1 ,二者相差很大的原因是____________。
(5)D与E形成化合物晶体的晶胞如下图所示:

①在该晶胞中,E的配位数为__________。
②原子坐标参数可表示晶胞内部各原子的相对位置。上图晶胞中,原子的坐标参数为a为(0,0,0);b(1/2,0,1/2);c为(1/2,1/2,0)。则d原子的坐标参数为_______。
③已知该晶胞的密度为ρg/cm3,则其中两个D原子之间的距离为____pm(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用含有少量镁的铝片制取纯净的Al(OH)3,可能有的步骤为:① 加盐酸溶解;② 加过量苛性钠溶液;③ 过滤;④ 通入过量CO2;⑤ 加过量纯碱溶液,实验操作最合理的组合及顺序是
A. ①⑤④③ B. ②③④③ C. ②③⑤③① D. ①⑤③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是
A. 光导纤维的主要成分是SiO2
B. 玻璃和陶瓷都属于传统硅酸盐材料
C. 明矾和漂白粉均可用于自来水的杀菌、消毒
D. 大量排放SO2会引起酸雨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现将0.40 mol A气体和0.20 mol B气体充入10 L的密闭容器中,在一定条件下使其发生反应生成气体C,其物质的量的变化如图:
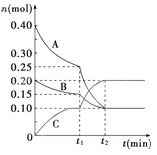
(1)若t1=10 min,则0至t1时间内C物质的平均反应速率为________________;反应在t2时达到平衡,其化学方程式为_____________________________________。
(2)该反应t2时刻反应化学平衡常数为K=________________________。
(3)据图中曲线变化情况分析,t1时刻改变的反应条件可能是________。
A.加入了催化剂 B.降低了反应温度
C.向容器中充入了C D.缩小了容器体积
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com