
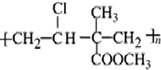
 ,其单体为:CH2=CHCl、CH2=C(CH3)COOCH3.
,其单体为:CH2=CHCl、CH2=C(CH3)COOCH3.分析 (1)由高聚物结构简式的可知,主链含有4个C原子,单体有2种,据此解答;
(2)①4Al(s)+3O2(g)═2Al2O3(s)△H=-2830kJ•mol-1,
②Fe2O3(s)+$\frac{3}{2}$C(s)=$\frac{3}{2}$CO2(g)+2Fe(s)△H=+230kJ•mol-1,
③C(s)+O2(g)═CO2(g)△H=-390kJ•mol-1,
由盖斯定律可知,①×$\frac{1}{2}$+②-③×$\frac{3}{2}$可得到2Al(s)+Fe2O3(s)=Al2O3(s)+2Fe(s).
解答 解:(1)由高聚物 的结构可知,主链含有4个C原子,单体有2种,故其单体为:CH2=CHCl、CH2=C(CH3)COOCH3,故答案为:CH2=CHCl、CH2=C(CH3)COOCH3;
的结构可知,主链含有4个C原子,单体有2种,故其单体为:CH2=CHCl、CH2=C(CH3)COOCH3,故答案为:CH2=CHCl、CH2=C(CH3)COOCH3;
(2)①4Al(s)+3O2(g)═2Al2O3(s)△H=-2830kJ•mol-1,
②Fe2O3(s)+$\frac{3}{2}$C(s)=$\frac{3}{2}$CO2(g)+2Fe(s)△H=+230kJ•mol-1,
③C(s)+O2(g)═CO2(g)△H=-390kJ•mol-1,由盖斯定律可知,①×$\frac{1}{2}$+②-③×$\frac{3}{2}$可得到2Al(s)+Fe2O3(s)=Al2O3(s)+2Fe(s),
则△H=(-2830kJ•mol-1)×$\frac{1}{2}$+(+230kJ•mol-1)-(-390kJ•mol-1)×$\frac{3}{2}$=-600kJ/mol,
故答案为:2Al(s)+Fe2O3(s)=Al2O3(s)+2Fe(s)△H=-600kJ/mol.
点评 本题考查高分子化合物的结构、有机物的命名、盖斯定律计算反应热及书写热化学反应方程式,难度中等,关键是根据高分子链节,结合单体间发生的反应机理来判断其单体.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol•L-1K2SO4溶液中含有钾离子数为2NA | |
| B. | 0.1mol铁与0.1mol氯气点燃完全反应,转移电子数为0.3NA | |
| C. | 常温常压下,6.4g氧气和臭氧混合气体中含有的原子总数为0.4NA | |
| D. | 1L1mol•L-1氨水中,含有的NH3与NH3•H20分子的总数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl溶液(I2)用CCl4萃取 | B. | NO(NH3)通过水洗涤 | ||
| C. | NaCl(NH4Cl)加热固体混合物 | D. | N2(NO2)通过水洗涤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
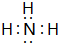 ;分子中既含有极性共价键、又含有非极性共价键的18电子化合物有H2O2、N2H4(写出其中两种的化学式).
;分子中既含有极性共价键、又含有非极性共价键的18电子化合物有H2O2、N2H4(写出其中两种的化学式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+、Fe3+、NO3-、SCN- | B. | Al3+、Fe2+、Cl-、SO42- | ||
| C. | K+、Na+、Cl-、HCO3- | D. | Na+、Ca2+、NO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 元素周期表的用途广泛.
元素周期表的用途广泛.| 离子半径 | 非金属性 | 酸性 | 沸点 |
| K+<S2- | N<O | 硫酸<高氯酸 | HF>HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C5H12O的醇能够被催化氧化生成醛,该醇的同分异构体有4种 | |
| B. | 将苯、溴水和铁屑混合制溴苯 | |
| C. | (C6H10O5)n可以是淀粉或纤维素,二者均属于多糖,且互为同分异构体 | |
| D. | 若不考虑立体异构,分子式为C4H8O2且为酯的同分异构体有3种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com