


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
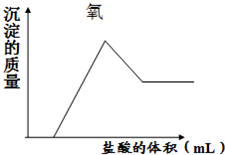 (1)某矿石由几种常见氧化物组成,组成这些氧化物的元素在地壳中的含量都很丰富.向该矿石混合粉末中加入过量的氢氧化钠溶液,过滤得可用作红色涂料的红棕色固体和无色溶液,然后向所得溶液中滴入盐酸,所得沉淀的质量与所加盐酸的体积的关系如图所示:
(1)某矿石由几种常见氧化物组成,组成这些氧化物的元素在地壳中的含量都很丰富.向该矿石混合粉末中加入过量的氢氧化钠溶液,过滤得可用作红色涂料的红棕色固体和无色溶液,然后向所得溶液中滴入盐酸,所得沉淀的质量与所加盐酸的体积的关系如图所示:| 离子 | Na+ | K+ | XO32- | SO42- |
| 浓度(mol?L-1) | 0.3 | 0.2 | 0.05 | 0.15 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、中和滴定时,用标准液润洗滴定管,用待测液润洗锥形瓶,并滴入l mL指示剂 |
| B、配制物质的量浓度溶液时,将称量好的溶质溶于盛有适量水的烧杯中,溶解后立即倾入容量瓶中,继续进行洗涤和定容 |
| C、制取Fe(OH)2时,吸取NaOH溶液的胶头滴管的末端应插入FeSO4溶液中,再缓缓将NaOH溶液挤出 |
| D、溴乙烷和烧碱溶液共热后,将硝酸银溶液滴入水解液中,即可见到淡黄色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、图1表示在含等物质的量NaOH、Na2CO3的混合溶液中滴加0.1mol?L-1盐酸至过量时,产生气体的体积与消耗盐酸的关系 |
| B、图2表示Cl2通入H2S溶液中pH的变化 |
| C、图3表示10 mL 0.01 mol?L-1KMnO4 酸性溶液与过量的0.1 mol?L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化(Mn2+对该反应有催化作用) |
| D、图4表示已达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件一定是加入催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验中使用的主要仪器是分液漏斗 |
| B、碘在四氯化碳中的溶解度比在水中的溶解度大 |
| C、不可把萃取剂四氯化碳换成酒精 |
| D、分液时,水从分液漏斗下口流出,碘的四氯化碳溶液从分液漏斗上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
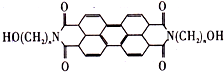 变色龙的外表随环境变化时一种生物的适应性,保护色在军事上用于进行“地表伪装”一直备受战争专家的青睐,BAFS是最近开发的芘系新型红外伪装还原染料,该染料为橄榄色或黑色,其化学结构如图,当n=3时,其一氯代物(不考虑醇羟基被取代)可能有( )
变色龙的外表随环境变化时一种生物的适应性,保护色在军事上用于进行“地表伪装”一直备受战争专家的青睐,BAFS是最近开发的芘系新型红外伪装还原染料,该染料为橄榄色或黑色,其化学结构如图,当n=3时,其一氯代物(不考虑醇羟基被取代)可能有( )| A、3种 | B、5种 | C、6种 | D、7种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com