
下列各组离子在指定的环境中能大量存在的是
A.pH=1的无色溶液中:SO42—、Cu2+、Na+、Cl—
B.能使石蕊试纸变蓝色的溶液中:Na+、K+、S2—、CO32—
C.加入铝粉能产生H2的溶液中:NH4+、Na+、Fe2+、NO3—
D.水电离出的c(H+)=1×10-12mol/L的溶液中:K+、Na+、Cl-、HCO3—
科目:高中化学 来源: 题型:
已知:I2+2S2O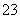 ===S4O
===S4O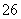 +2I-
+2I-
相关物质的溶度积常数见下表:
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2·2H2O晶体,加入____ ____,调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=__ ______。过滤后,将所得滤液低温蒸发、浓缩结晶,可得CuCl2·2H2O晶体。
(2)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,原因是(用化学方程式表示)_________________ ____________。由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是_________ ___________________。
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.100 0 mol·L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
①可选用______ __作滴定指示剂,滴定终点的现象是__________________ ____。
②CuCl2溶液与KI反应的离子方程式为__________ ________________。
③该试样中CuCl2·2H2O的质量百分数为____ ____。
查看答案和解析>>
科目:高中化学 来源: 题型:
某恒温恒容的容器中,建立如下平衡:2NO2(g) N2O4(g),在相同条件下, 若分别向容器中通入一定量的NO2气体或N2O4气体,重新达到平衡后,容器内N2O4的体积分数比原平衡时( )
N2O4(g),在相同条件下, 若分别向容器中通入一定量的NO2气体或N2O4气体,重新达到平衡后,容器内N2O4的体积分数比原平衡时( )
A.都增大 B.都减小
C.前者增大后者减小 D.前者减小后者增大
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,石灰乳悬浊液中存在下列平衡:Ca(OH)2(s) 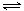 Ca2+(aq)+2OH–(aq),向一定量的石灰乳悬浊液中加入少量生石灰时,下列说法正确的是
Ca2+(aq)+2OH–(aq),向一定量的石灰乳悬浊液中加入少量生石灰时,下列说法正确的是
A.溶液中Ca2+离子数目减少 B.溶液中c(Ca2+)增大
C.溶液的pH增大 D.溶液中溶质的质量分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
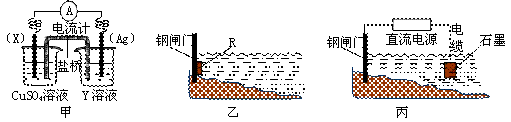
(1)依据反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如下图甲所示。
① 电极X的材料是 ;
② 外电路中的电子是从 电极流向 电极(填电极材料名称或符号)。
③ 在电池放电过程中,盛有饱和KCl琼脂溶胶的盐桥中,向CuSO4溶液一端扩散的离子是 (填离子符号)。
(2)① 金属腐蚀一般可分为化学腐蚀和电化学腐蚀。炒过菜的铁锅未及时清洗容易发生电化学腐蚀而生锈。请写出铁锅生锈过程的正极反应式: 。
② 为了减缓某水库铁闸门被腐蚀的速率,可以采用下图乙所示的方案,其中焊接在铁闸门上的固体材料R可以采用 (填写字母序号)。
A.铜 B.钠 C.锌 D.石墨
③ 图丙所示方案也可以减缓铁闸门的腐蚀速率,则铁闸门应连接直流电的 极。
(3)蓄电池是一种可以反复充电、放电的装置。有一种蓄电池在充电和放电时发生的反应是:NiO2 + Fe + 2H2O Fe(OH)2 + Ni(OH)2。
Fe(OH)2 + Ni(OH)2。
① 若此蓄电池放电时,该电池某一电极发生还原反应的物质是 (填序号)。
A.NiO2 B.Fe C.Fe(OH)2 D.Ni(OH)2
② 该电池放电时,正极附近溶液的PH (填增大、减小、不变)
③ 充电时该电池阳极的电极反应式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应①:CO(g)+CuO(s)  CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)
CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)  Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③:
Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③:
CO(g)+H2O(g)  CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
A.反应①的平衡常数K1=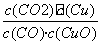
B.反应③的平衡常数K=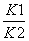
C.对于反应③,恒容时,温度升高,H2浓度减小,则该反应为吸热反应
D.对于反应③,恒温恒容下,增大压强,H2浓度一定增大
查看答案和解析>>
科目:高中化学 来源: 题型:
乙二酸俗称草酸,为二元酸(结构简式为HOOC﹣COOH,可简写为H2C2O4).25℃时,草酸的电离平衡常数K1=5.0×10﹣2,K2=5.4×10﹣5;碳酸的电离平衡常数K1=4.5×10﹣7,K2=4.7×10﹣11.草酸钙的Ksp=4.0×10﹣8,碳酸钙的Ksp=2.5×10﹣9.回答下列问题:
(1)写出水溶液中草酸的电离方程式: .
(2)25℃,物质的量浓度都为0.1mol/L的Na2C2O4溶液的pH比Na2CO3溶液pH (填“大”“小”或“相等”).
(3)常温下将0.2mol/L的KOH溶液10mL与0.2mol/L的草酸溶液10mL混合,若混合溶液显酸性,则该溶液中所有离子浓度由大到小的顺序: .
(4)25℃时向20mL碳酸钙的饱和溶液中逐滴加入1.0×10﹣3 mol/L的草酸钾溶液20mL,能否产生沉淀? 否 (填“能”或“否”).
(5)除去锅炉水垢中的CaSO4可先用碳酸钠溶液处理,而后用盐酸溶解,其反应的离子方程式: ; .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com