
 2015������ը�¹��У���ը������²��־綾�����軯�ƣ�NaCN��й©����������ר�Ŵ���С�飬ͨ������˫��ˮ�������������Һ���������Լ�����Ⱦ��
2015������ը�¹��У���ը������²��־綾�����軯�ƣ�NaCN��й©����������ר�Ŵ���С�飬ͨ������˫��ˮ�������������Һ���������Լ�����Ⱦ������ ��1��NaCNΪǿ�������Σ�ˮ��ʼ��ԣ�˵��HCNΪ���
��2�������£��軯���������������Һ��Ӧ��������ʹʪ��ĺ�ɫʯ����ֽ����ɫ�����壬������Ϊ���������ɵ���ʽ��Ϊ̼�����ƣ���ƽ��д����ʽ��
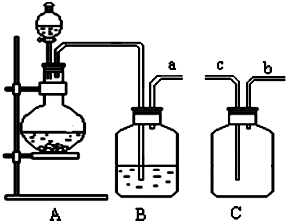
ʵ��һ��aװ���Ʊ���������cװ�����Ʊ�Na2S2O3����Ӧ����װ������ѹ��С��bΪ��ȫƿ���ã���ֹ��Һ������dװ�����ն���Ķ�������ֹ��Ⱦ������
��3���������ṹ��������֪ʢװNa2SO3���������ΪԲ����ƿ��bװ��Ϊ��ȫƿ��
��4��dװ�����ն�������d��������NaOH��Na2CO3������������������������ɣ�
��5���������װ��b�л��в����Ķ�������Ϊ��ֹ��Ⱦ������Ӧ������������Һ���գ�
��6��Ag+��CN-��Ӧ����[Ag��CN��2]-����CN-��Ӧ����ʱ��Ag+��I-����AgI��ɫ������˵����Ӧ����ζ��յ㣻
��7�������������������ʵ������ٸ��ݷ���ʽAg++2CN-=[Ag��CN��2]-������軯�Ƶĺ�����
��� �⣺��1��NaCNΪǿ�������Σ�ˮ��ʼ��ԣ�˵��HCNΪ���ᣬ���뷽��ʽΪ��HCN?H++CN-���ʴ�Ϊ��HCN?H++CN-��
��2�������£��軯���������������Һ��Ӧ��������ʹʪ��ĺ�ɫʯ����ֽ����ɫ�����壬������Ϊ���������ɵ���ʽ��Ϊ̼�����ƣ���Ӧ����ʽΪ��NaCN+H2O2+H2O=NaHCO3+NH3����
�ʴ�Ϊ��NaCN+H2O2+H2O=NaHCO3+NH3����
ʵ��һ��aװ���Ʊ���������cװ�����Ʊ�Na2S2O3����Ӧ����װ������ѹ��С��bΪ��ȫƿ���ã���ֹ��Һ������dװ�����ն���Ķ�������ֹ��Ⱦ������
��3���������ṹ��������֪ʢװNa2SO3���������������ΪԲ����ƿ��bװ��Ϊ��ȫƿ����ֹ������
�ʴ�Ϊ��Բ����ƿ����ȫƿ����ֹ������
��4��dװ�����ն�������d��������NaOH��Na2CO3������������������������ɣ�
�ʴ�Ϊ��Na2SO3��
��5���������װ��b�л��в����Ķ�������Ϊ��ֹ��Ⱦ������Ӧ������������Һ���գ�
�ʴ�Ϊ��NaOH��Һ��
��6��Ag+��CN-��Ӧ����[Ag��CN��2]-����CN-��Ӧ����ʱ���������һ����������Һ��Ag+��I-����AgI��ɫ������˵����Ӧ����ζ��յ㣬
�ʴ�Ϊ���������һ��AgNO3��Һ�����ֻ�ɫ�������Ұ����֮�ڲ���ʧ��
��7������AgNO3�����ʵ���Ϊ��2.5��10-3L��0.0001mol/L=2.50��10-7mol�����ݷ���ʽAg++2CN-=[Ag��CN��2]-�������ķ�ˮ���軯�Ƶ�����Ϊ2.50��10-7mol��2��49g/mol=2.45��10-5g����ˮ���軯�Ƶĺ���Ϊ��$\frac{2.45��1{0}^{-2}mg}{0.025L}$=0.98mg/L��
�ʴ�Ϊ��0.98��
���� ���⿼�������Ʊ�ʵ�顢���ʺ����ⶨ��֪ʶ����Ŀ�Ѷ��еȣ������ۺ��Խ�ǿ���ؼ��Ƕ�ԭ�������⣬ע���Ʊ������뻷����ʶ����������Ԫ�ػ�����֪ʶ��ʵ���Ʊ�����ԭ������������ѧ���ķ�����������������ѧʵ��������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �� NaHCO3 ��Һ��һ�μ����ϡ���ᡢNaOH��Һ��AlCl3��Һ��NaAlO2 ��Һ | |
| B�� | ��������Լ�ƿ�ڱ��Ϻ�ɫ���ʿ���ϡ����ϴ�� | |
| C�� | ��ȥSO2 ������HCl������ͨ�뱥�͵�Na2SO3 ��Һ | |
| D�� | ��NaOH��Һ��μ��뱥��FeCl3��Һ��ȡFe��OH��3���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 25��ʱ��pH=11 NaOH��Һ��pH=3 CH3COOH��ϣ�����Һ�����ԣ���������Һ������Ũ�ȿ���Ϊ��c��CH3COO-����c��H+����c��Na+����c��OH-�� | |
| B�� | ȡc��H+��=0.01mol•L-1������ʹ����100mL���ֱ�ϡ��2�����ٷֱ����0.03gп�ۣ�����ͬ�����³�ַ�Ӧ��������п��Ӧ�����ʴ� | |
| C�� | ��Ũ�����ữ��KMnO4��Һ��H2O2��Ӧ��֤��H2O2���л�ԭ�ԣ�2MnO$_4^-$+6H++5H2O2=2Mn2++5O2��+8H2O | |
| D�� | �������ʵ�����NaHC2O4��Na2C2O4����Һ�д��ڣ�2c��Na+��=3[c��HC2O4-��+c��C2O42-��+c��H2C2O4��] |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
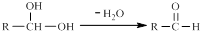 ���������ͼ�ش�
���������ͼ�ش�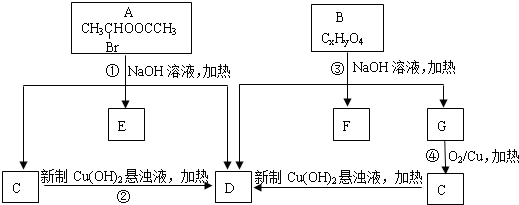
 ��
�� �� ��
�� �� ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ϴ������ʱ����ʹ�ú���ϴ�·ۣ�������ˮ��ֲ������� | |
| B�� | ��2008��6��1������ȫ����Χ�ڽ�ֹ���������ۡ�ʹ�ó������Ϲ���� | |
| C�� | ��ú����������Һ���Ի�ýྻ��ȼ�� | |
| D�� | ���á���ɫ��ѧ�����գ����������Ѻ��ͻ�����ϵ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
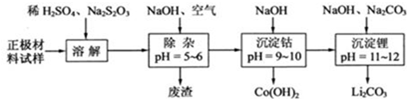
| A�� | �������ܽ�����У�S2O32-��������SO42-��LiCoO2���ܽ�����з����ķ�Ӧ8LiCoO2+Na2S2O3+11H2SO4�T4 Li2SO4+8CoSO4+Na2SO4+11H2O | |
| B�� | ����pH=5-6��Ŀ����ʹFe3+��Al3+ת��ΪFe��OH��3��Al��OH��3��ȥ | |
| C�� | Co��OH��2������ȫ����Һ�в�����Co2+ | |
| D�� | Li��Mg�����ڱ��д��ڶԽ���λ�ã������������ԣ���˵���Li���õ�ⷨ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
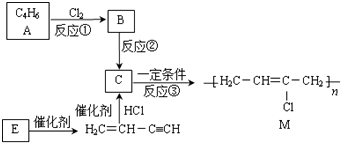
 ���÷�Ӧ����������ȥ��Ӧ��
���÷�Ӧ����������ȥ��Ӧ�� ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com