
| A.用食醋除去热水瓶胆壁上的水垢 | B.用次氯酸钠溶液消毒浴池 |
| C.盐卤用于制豆腐 | D.用小苏打发酵面团制作馒头 |


科目:高中化学 来源:不详 题型:单选题
| A.水在化学反应中既可以作氧化剂,又可以作还原剂 |
| B.1molCl2与足量Fe反应,转移的电子数为3NA |
| C.发生化学反应时失去电子数越多的金属原子,还原能力越强 |
| D.若A2+2D- =2A-+D2,则氧化性:D2>A2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
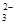 +O2+xOH—
+O2+xOH— +2H2O,
+2H2O,| A.每生成1mol Fe3O4,反应转移的电子总数为3mol ; |
| B.x="6" |
| C.1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为1/3mol; |
| D.Fe2+和S2O32—-都是还原剂; |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
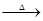 3HNCO;8HNCO+6NO2
3HNCO;8HNCO+6NO2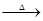 7N2+8CO+4H2O。
7N2+8CO+4H2O。| A.C3N3(OH)3与HNCO为同一物质 | B.1mol HNCO与NO2反应时转移3mol电子 |
| C.HNCO是强氧化剂 | D.反应中CO2是氧化产物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀 时的pH | 1.9 | 7.0 | — | — | 4.7 | — |
| 沉淀完全 时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9(>9溶解) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1:10 | B.1:8 | C.1:6 | D.1:5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CHCl3 | B.CH3CH2Br |
| C.CH2BrCH2CH2OH | D.CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CuSO4和FeS2是氧化剂,FeS2是还原剂 |
| B.5 mol FeS2发生反应,有21 mol e—转移 |
| C.Cu2S既是氧化产物又是还原产物 |
| D.产物中的SO42-有一部分是氧化产物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com