
【题目】实验中需2 mol·L-1的碳酸钠溶液950 mL,配制时应选用的容量瓶的规格是
A. 1 000 mL B. 950 mL C. 900 mL D. 500 mL
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】硅酸铜钡是当今用最新科学技术才能合成的一种物质。然而现在发现,我国秦朝兵马俑用的一种颜料竟是硅酸铜钡。下列关于硅酸铜钡的说法错误的是( )
A. 属于盐B. 难溶于水C. 属于硅酸盐D. 易溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阴离子和阳离子都为稀有气体元素原子结构,且阳离子比阴离子少两个电子层的离子化合物是( )
A. MgCl2B. BaF2C. NaBrD. NaI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若用AG表示溶液的酸度,其表达式为:![]() 。室温下,实验室里用0.1mol/L的盐酸溶液滴定10mL 0.1mol/L MOH溶液,滴定曲线如下图所示。下列说法正确的是
。室温下,实验室里用0.1mol/L的盐酸溶液滴定10mL 0.1mol/L MOH溶液,滴定曲线如下图所示。下列说法正确的是
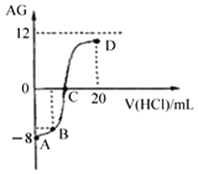
A. 该滴定过程可选择酚酞作为指示剂
B. C点时加入盐酸溶液的体积等于10 mL
C. 溶液中由水电离的c(H+):C点>D点
D. 若B点加入的盐酸溶液体积为5 mL,所得溶液中:c(M+)+c(H+)= c(MOH)+ c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是一种工业盐,外观与食盐相似。下面是某学习小组设计的NaNO2制取实验和纯度检验实验。该小组收集了相关资料:
①SO2和HNO3溶液反应生成NOx和H2SO4
②3NO2-+2H+=2NO↑+NO3-+H2O
③NO2-+Ag+=AgNO2↓(AgNO2为淡黄色接近白色固体,在水中形成沉淀)
Ⅰ.亚硝酸钠的制取实验

(1)仪器a的名称为________________________,A装置中发生的化学反应方程式为_____________________________________________。
(2)B装置中多孔球泡的作用是_________________________________________________。
(3)若装置B中逸出的NO与NO2气体物质的量之比为2∶1,则装置B中发生反应的化学方程式为_________________________________________________________。
(4)实验过程中需控制C装置中溶液pH>7,否则C中生成的NaNO2的产量会下降,理由是_____________________________________________________。
(5)请根据题干所给信息设计实验证明C装置中有NO2产生:_________________________________。(限选用的试剂:稀硝酸、硝酸银溶液、NaOH溶液)
Ⅱ.亚硝酸钠的纯度检验
已知:NO2-+MnO4-+H+→NO3-+Mn2++H2O
(6)反应结束后C中溶液通过结晶获得NaNO2粗产品mg,溶解后稀释至250mL,分别取25.00mL用cmol/L的酸性KMnO4溶液平行滴定三次,平均每次消耗酸性KMnO4溶液的体积为VmL。则粗产品中NaNO2的质量分数为_____________(用含c、V、m的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列计算结果正确是( )
A. 0.5L、8mol/L 浓盐酸与足量MnO2完全反应产生22.4L(标准状况下)Cl2
B. 2H2S+SO2═3S↓+2H2O反应中氧化产物与还原产物的物质的量之比为1:2
C. 将NO2和O2等体积混合充满一试管,倒置于水槽中,充分反应后,试管中剩余气体占试管容积的![]()
D. 标准状况下,用一充满HCl气体的干燥烧瓶做喷泉实验,当水充满整个烧瓶后(假设溶液不外溢),烧瓶内盐酸的物质的量的浓度为![]() mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于甲烷、乙烷、丙烷的说法正确的是( )
A. 它们的分子空间结构都是正四面体B. 都能使酸性高锰酸钾溶液褪色
C. 光照条件下,都能与氯气发生取代反应D. 乙烷的熔、沸点比丙烷高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了如图装置制取和验证SO2的性质。

请回答:
(1)写出A反应装置中的化学方程式:____________
(2)棉球中NaOH溶液的作用是________________
(3)为了验证SO2是酸性氧化物,洗气瓶②中可选择的试剂是_________。
A.澄清石灰水 B.无色酚酞试液 C.碘水 D.紫色石蕊试液
(4)下列说法正确的是____________。
A.先向装置中加入试剂(药品),再进行气密性检查
B.实验开始时,只需打开分液漏斗的旋塞,即可使液体顺利滴下
C.实验开始后,洗气瓶①和③中溶液均褪色,两者均可证明SO2具有漂白性
D.实验开始后,洗气瓶④中可观察到白色沉淀产生,该现象可说明SO2具有还原性
(5)写出洗气瓶③中反应的化学方程式:_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅的单质、氧化物、铅盐在现代工业中有着重要的用途。
(1)工业利用锌冶炼过程中的铅浮渣生产硫酸铅的流程如下[已知铅浮渣的主要成分是PbO、Pb,还含有少量Ag、Zn、CaO和其他不溶于硝酸的杂质。

①生产过程中,必须使浸出渣中仍含少量的铅单质,其目的是_________,废液中存在可循环利用于的物质,该物质是_______ , 加40%硫酸的目的是 _______
②写出酸浸过程中单质铅反应的化学方程式:______,若沉淀物含有极少量CaSO4,则洗涤剂最好使用____
a.水 b.10%硫酸、水 c.Pb(NO3)2溶液、水
(2)已知铅能形成多种氧化物,如碱性氧化物PbO、酸性氧化物PbO2以及Pb3O4。Pb3O4能与硝酸发生非氧化还原反应生成一种盐和一种铅的氧化物,写出反应的化学方程式______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com