
环境监测测定水中含氧气的方法是:量取aml水样,迅速加入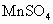 及含有NaOH的KI溶液,塞好塞子,振荡使反应均匀后,开塞,迅速加入硫酸,此时有碘生成,用浓度为bmol·
及含有NaOH的KI溶液,塞好塞子,振荡使反应均匀后,开塞,迅速加入硫酸,此时有碘生成,用浓度为bmol·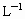 的
的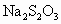 溶液和碘反应,消耗Vml(用淀粉作指示剂).上述过程的反应为:
溶液和碘反应,消耗Vml(用淀粉作指示剂).上述过程的反应为:
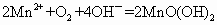
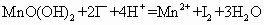
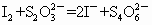
(1)水中溶解的氧气的量为多少?(用含a、b、V字母形式表示,单位mg/L)________
(2)以淀粉作指示剂,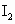 和
和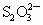 的反应达到反应终点时,溶液颜色变化情况是________.
的反应达到反应终点时,溶液颜色变化情况是________.
(3)开塞到加硫酸之间的间隔时间若过长,测得结果比实际值________(填“高”、“低”或“不变”),原因是________.
科目:高中化学 来源:物理教研室 题型:022
①量取amL水样,迅速加人固定剂MnSO4溶液和碱性KI溶液(含有KOH),立即塞好瓶塞,反复振荡,使之充分反应,其反应式为:2Mn2+O2+4OH-═══2MnO(OH)2(该反应极快)。
②测定:开塞后迅速加入1mL~2mL浓H2SO4(提供H+)使之生成I2,再用bmol•L-1的Na2S2O3溶液滴定(以淀粉为指示剂),消耗VmL,有关反应的方程式为:MnO(OH)2+2I-+4H+═══Mn2+I2+3H2O、
![]() O
O![]() ═══2I-+
═══2I-+![]() O
O![]() amL水中溶氧的量的计算式是________。
amL水中溶氧的量的计算式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:022
环境监测测定水中溶氧的方法是:
①量取amL水样,迅速加人固定剂MnSO4溶液和碱性KI溶液(含有KOH),立即塞好瓶塞,反复振荡,使之充分反应,其反应式为:2Mn2+O2+4OH-═══2MnO(OH)2(该反应极快)。
②测定:开塞后迅速加入1mL~2mL浓H2SO4(提供H+)使之生成I2,再用bmol•L-1的Na2S2O3溶液滴定(以淀粉为指示剂),消耗VmL,有关反应的方程式为:MnO(OH)2+2I-+4H+═══Mn2+I2+3H2O、
![]() O
O![]() ═══2I-+
═══2I-+![]() O
O![]() amL水中溶氧的量的计算式是________。
amL水中溶氧的量的计算式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
2Mn2++O2+4OH- ![]() 2MnO(OH)2(反应快)
2MnO(OH)2(反应快)
MnO(OH)2+2I-+4H+ ![]() Mn2++I2+3H2O
Mn2++I2+3H2O
I2+2![]()
![]() 2I-+
2I-+![]()
(1)水中溶解O2的量(以mg·L-1为单位)为多少?
(2)I2和![]() 反应以淀粉为指示剂,达到终点时溶液的颜色如何变化?
反应以淀粉为指示剂,达到终点时溶液的颜色如何变化?
(3)加MnSO4及含NaOH的KI溶液后振荡时,若塞子未塞紧(设振荡时未溅出溶液),测定结果与(1)中的计算结果相比有差别吗?为什么?
(4)开塞到加H2SO4前的时间间隔很长,测定结果又如何?说明理由。
查看答案和解析>>
科目:高中化学 来源: 题型:
环境监测测定水中溶解O2的方法是:量取aml水样于一个锥形瓶中,迅速往其中加入MnSO4溶液及含有NaOH的KI溶液,立即塞好塞子,振荡使反应均匀.打开塞,迅速加入适量硫酸溶液,此时有I2生成.用硫代硫酸钠溶液(浓度为bmol/L)和I2反应(滴定),消耗了Vml(以淀粉指示剂).有关反应的方程式为:2Mn2++O2+4OH-=2MnO(OH)2(反应很快)
MnO(OH)2+2I-+4H+=Mn2++I2+3H2O
I2+2![]() =2I-+S4O2-6
=2I-+S4O2-6
(1)水中溶解O2的量(以mg/L为单位)为多少?
(2)I2和S2O2-3反应以淀粉为指示剂,达终点时溶液颜色如何变化?
(3)加MnSO4及含KI的NaOH溶液后,振荡时,若塞子未塞紧(设振荡时未溅出溶液),测定结果与塞紧塞子测定的结果相比如何?为什么?
(4)打开塞子到加硫酸溶液前的时间间隔很大,测定结果又如何?说明理由.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com