
| A. | 除去CO中少量O2:通过灼热的Cu网后收集气体 | |
| B. | 除去K2CO3中少量NaHCO3:置于坩埚中加热 | |
| C. | 除去N2中少量NH3,可依次通过水、浓H2SO4洗后收集气体 | |
| D. | 可用铁粉除去FeCl3溶液中的少量的CuCl2 |
分析 A、一氧化碳是可燃性气体;
B、碳酸氢钠受热分解生成碳酸钠;
C、氮气是难溶于水的中性气体;
D、铁粉会先和氯化铁反应.
解答 解:A、一氧化碳是可燃性气体,故将一氧化碳和氧气的混合气体通入灼热铜网会发生爆炸,故A错误;
B、碳酸氢钠受热分解生成碳酸钠,故用加热的方法能除去碳酸氢钠,但又引入碳酸钠,故B错误;
C、氮气是难溶于水的中性气体,氨气是极易溶于水的碱性气体,故将氮气和氨气混合气体通入水中,氨气溶解,再继续通入浓硫酸即得干燥纯净的氮气,故C正确;
D、铁粉会先和氯化铁反应生成氯化亚铁,故D错误.
故选C.
点评 本题考查了化学实验中的除杂问题的试剂选择和实验方案设计,难度不大,掌握杂质和主体物质的性质的异同点是解题关键.


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:实验题
| 盐 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | -- | -- | -- | -- |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.l | 12.7 | 14.5 | 16.4 | -- |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
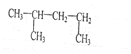
| A. | ②⑤⑥ | B. | ②④ | C. | ④⑤ | D. | ①③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1:3:6 | B. | 2:1:6 | C. | 3:5:12 | D. | 1:1:6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 75% | B. | 50% | C. | 5% | D. | 12.5% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 附近居民切忌惊慌,用毛巾护住口鼻,朝顺风方向或向避风的沟塘低洼处转移 | |
| B. | 要快速地将翻落的氯槽罐安全起吊移到水池,进行碱液稀释中和 | |
| C. | 液氯流淌速度很慢,居民不必惊慌,可以放心退到家中,关紧门窗 | |
| D. | 检修或现场抢救时,没有防毒面具,可以佩戴用浓碱溶液浸过的湿口罩 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂和蛋白质是人体必需的营养物质,都属于高分子化合物 | |
| B. | 食品包装袋中常有硅胶、生石灰、还原铁粉等,其作用都是吸水防止食品变质 | |
| C. | 采用催化转化技术,可将汽车尾气中的一氧化碳和氮氧化物转化为无毒气体 | |
| D. | 中医古籍《肘后备急方》中“青蒿一握,以水二升渍,绞取汁,尽服之”启发了屠呦呦采用低温提取青蒿素,该提取过程属于化学变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com