
【题目】物质的结构决定物质的性质。请回答下列涉及物质结构和性质的问题:
(1)氨气极易溶于水的主要原因是_____________________。
(2)某元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则其基态原子的外围电子排布式为________________。
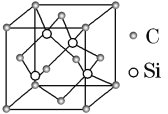
(3)碳化硅的结构与金刚石类似(如图所示),4个硅原子位于体心位置,碳原子位于顶点、面心位置,其硬度仅次于金刚石,具有较强的耐磨性能。碳化硅晶胞结构中每个硅原子周围与其距离最近的碳原子有_______个,碳化硅化学式为________。已知碳化硅晶胞边长为acm,阿伏加德罗常数为NA,则碳化硅的密度为_______g·cm3。
(4)(CH3)3N可用于制备医药、农药,则(CH3)3N_______(填“能”或“不能”)溶于水。化合物(CH3)3N与盐酸反应生成[(CH3)3NH]+,该过程新生成的化学键为_______。
a.离子键 b.配位键 c.氢键 d.非极性共价键
(5)成键原子中的孤电子对对键能有影响,第二周期元素A与氢形成的化合物中A-A键的键能(单位:kJ·mol-1)如下:H3C-CH3 346,H2N-NH2 247,HO-OH 207;
试分析上述化合物中A-A键的键能依次下降的原因__________________________。
【答案】 氨分子间存在氢键 3d84s2 4 SiC 160/NAa3 能 b 孤电子对越多,对成键电子的排斥挤压增强,导致轨道重叠程度减小,成键能力下降,键能下降
【解析】
(1)由于氨分子间存在氢键,因此氨气极易溶于水;
(2)某元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,碳原子有2个未成对电子,因此该元素是Ni,则其基态原子的外围电子排布式为3d84s2;
(3)4个硅原子位于体心位置,即晶胞中含有4个Si。碳原子位于顶点、面心位置,则晶胞中含有的碳原子个数是8×1/8+6×1/2=4,所以其化学式是SiC。碳化硅晶胞结构中每个硅原子周围与其距离最近的碳原子有4个,以硅原子为中心构成四面体。已知碳化硅晶胞边长为a cm,则其体积是a3 cm3,阿伏加德罗常数为NA,所以碳化硅的密度为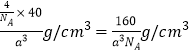 ;
;
(4)极性分子(CH3)3N和水之间能形成氢键,所以(CH3)3N能溶于水。化合物(CH3)3N与盐酸反应生成[(CH3)3NH]+,该过程新生成的化学键为氮与氢离子形成配位键,答案选b;
(5)根据键能数据可知由于孤电子对越多,对成键电子的排斥挤压增强,导致轨道重叠程度减小,成键能力下降,键能下降,因此上述化合物中A-A键的键能依次下降。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知在元素周期表中,A、B均为前四周期主族元素,且A位于B的下一周期。某含氧酸盐X的化学式为ABO3。请回答:
(1)若常温下B的单质为黄绿色气体。
①A在元素周期表中的位置是_______________________。
②下列说法正确的是_________(填代号)。
a.A单质的熔点比B单质的熔点低
b.A的简单离子半径比B的简单离子半径大
c.A、B元素的最高价氧化物对应的水化物都是强电解质
d.化合物X中既含有离子键又含有共价键
③400℃时,X能发生分解反应生成两种盐,其物质的量之比为1∶3,其中一种是无氧酸盐。该反应的化学方程式为_____________________________________________。
(2)若X能与稀硫酸反应,生成无色、无味的气体。
①该气体分子的电子式为______________________。
②X在水中持续加热,发生水解反应,生成一种更难溶的物质并逸出气体,反应的化学方程式为__________________________________________。
③X可用作防火涂层,其原因是:a.高温下X发生分解反应时,吸收大量的热;
b. __________________________________________(任写一种)。
(3)若X难溶于水,在空气中易氧化变质,B元素原子的最外层电子数是其电子层数的2倍。X能快速消除自来水中的C1O-,该反应的离子方程式为______________________________________。
(4)用一个化学方程式证明上述(1)、(3)两种情况下化合物X中B元素非金属性强弱________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A是近年来采用的锅炉水添加剂,其结构式如图,A能除去锅炉水中溶解的氧气,下列说法正确的是( )
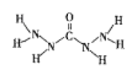
A. A分子中所有原子都在同一平面内
B. A分子中所含的σ键与π键个数之比为10:1
C. 所含C、N均为sp2杂化
D. A与O2反应生成CO2、N2、H2O的物质的量之比为1:2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁触媒是重要的催化剂,CO易与铁触媒作用导致其失去催化活性:Fe+5CO=Fe(CO)5;除去CO的化学反应为:[Cu(NH3)2]OOCCH3+CO+NH3=[Cu(NH3)3(CO)]OOCCH3。
(1)基态Fe原子的外围电子排布式:________,C、N、O的第一电离能由大到小的顺序为________。
(2)Fe(CO)5又名羰基铁,常温下为黄色油状液体,则Fe(CO)5的晶体类型是_______,与CO互为等电子体的分子的电子式为______________。
(3)硝酸钾中NO3-的空间构型_______,分子中的大π键可用符号![]() 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为![]() ),则NO3-中的大π键应表示为____________。
),则NO3-中的大π键应表示为____________。
(4)配合物[Cu(NH3)2]OOCCH3中碳原子的杂化类型是________,配位体中提供孤对电子的原子是_____。
(5)用[Cu(NH3)2]OOCCH3除去CO的反应中,肯定有______形成.
a.离子键 b.配位键 c.非极性键 d.σ键
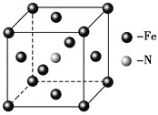
(6)铁和氨气在640 ℃可发生置换反应,产物之一的晶胞结构如图所示,写出该反应的化学方程式__________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇脱氢可制取甲醛:CH3OH(g) ![]() HCHO(g)+H2(g)+Q,甲醇的平衡转化率随温度变化曲线如图所示。下列有关说法正确的是( )
HCHO(g)+H2(g)+Q,甲醇的平衡转化率随温度变化曲线如图所示。下列有关说法正确的是( )

A. Q>0
B. 600 K时,Y点甲醇的v(正)<v(逆)
C. 从Y点到Z点可通过增大压强实现
D. 从Y点到X点可通过使用催化剂实现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,C的平均反应速率是0.1mol/(L·min),且此时A的物质的量浓度为0.25 mol/L。
xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,C的平均反应速率是0.1mol/(L·min),且此时A的物质的量浓度为0.25 mol/L。
(1)x的值是__________;
(2)B的平均反应速率__________;
(3)则反应开始前放入容器中A的物质的量_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com