
【题目】某研究性学习小组设计了将粗MnO2(含有较多的MnO和MnCO3)样品转化为纯MnO2的实验,其流程如下:
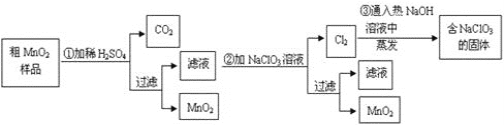
(1)第①步加稀H2SO4时,粗MnO2样品中的____(写化学式)转化为可溶性物质。
(2)第②步反应的离子方程式:_________
(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、酒精灯 、______、______,已知蒸发得到的固体中有NaClO3和NaOH,则一定还有____(写物质名称)。
(4)若粗MnO2样品的质量为12.69 g,第①步反应后,过滤得到8.7 gMnO2,并收集到0.224 L CO2(标准状况),则第②步反应中至少需要_______ g NaClO3。
【答案】MnO 、MnCO3 5Mn2++2ClO3-+4H2O=5MnO2↓+Cl2↑+8H+ 蒸发皿 玻璃棒 氯化钠 2.13
【解析】
(1)从流程看,第①步加稀H2SO4时,粗MnO2样品中只有MnO2不溶解,另两种物质都被硫酸溶解,转化为可溶性物质。
(2)第②步反应,是滤液中的Mn2+被ClO3-氧化为MnO2,ClO3-被还原为Cl2。
(3)第③步蒸发操作,应在蒸发皿中进行,使用玻璃棒搅拌,从而得出缺少的仪器,已知蒸发得到的固体中有NaClO3和NaOH,则一定还有Cl2的还原产物。
(4)若粗MnO2样品的质量为12.69 g,第①步反应后,过滤得到8.7 gMnO2,并收集到0.224 L CO2(标准状况),则MnCO3的物质的量为![]() =0.01mol,质量为0.01mol×115g/mol=1.15g,MnO的质量为12.69g-8.7 g-1.15g=2.84g,物质的量为
=0.01mol,质量为0.01mol×115g/mol=1.15g,MnO的质量为12.69g-8.7 g-1.15g=2.84g,物质的量为![]() ,则n(Mn2+)=0.01mol+0.04mol=0.05mol,依据第②步反应的离子方程式,可求出需要NaClO3的质量。
,则n(Mn2+)=0.01mol+0.04mol=0.05mol,依据第②步反应的离子方程式,可求出需要NaClO3的质量。
(1)从流程看,第①步加稀H2SO4时,粗MnO2样品中只有MnO2不溶解,MnO、MnCO3都被硫酸溶解,转化为可溶性物质。答案为:MnO、MnCO3;
(2)第②步反应,是滤液中的Mn2+被ClO3-氧化为MnO2,ClO3-被还原为Cl2,反应的离子方程式为5Mn2++2ClO3-+4H2O=5MnO2↓+Cl2↑+8H+。答案为:5Mn2++2ClO3-+4H2O
=5MnO2↓+Cl2↑+8H+;
(3)第③步蒸发操作,应在蒸发皿中进行,使用玻璃棒搅拌,从而得出缺少的仪器为蒸发皿、玻璃棒;已知蒸发得到的固体中有NaClO3和NaOH,则一定还有Cl2的还原产物氯化钠。答案为:蒸发皿;玻璃棒;氯化钠;
(4)若粗MnO2样品的质量为12.69 g,第①步反应后,过滤得到8.7 gMnO2,并收集到0.224 L CO2(标准状况),则MnCO3的物质的量为![]() =0.01mol,质量为0.01mol×115g/mol=1.15g,MnO的质量为12.69g-8.7 g-1.15g=2.84g,物质的量为
=0.01mol,质量为0.01mol×115g/mol=1.15g,MnO的质量为12.69g-8.7 g-1.15g=2.84g,物质的量为![]() ,则n(Mn2+)=0.01mol+0.04mol=0.05mol,依据第②步反应的离子方程式5Mn2++2ClO3-+4H2O=5MnO2↓+Cl2↑+8H+,可求出需要NaClO3的物质的量为0.02mol,质量为0.02mol×106.5g/mol=2.13g。答案为:2.13。
,则n(Mn2+)=0.01mol+0.04mol=0.05mol,依据第②步反应的离子方程式5Mn2++2ClO3-+4H2O=5MnO2↓+Cl2↑+8H+,可求出需要NaClO3的物质的量为0.02mol,质量为0.02mol×106.5g/mol=2.13g。答案为:2.13。


科目:高中化学 来源: 题型:
【题目】(1)写出下图中序号①~④仪器的名称:

①___________;②___________; ③___________; ④___________。
(2)仪器①~④中,使用时必须检查是否漏水的有__________(填仪器序号)。
(3)右图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容。现用该浓硫酸配制480 mL 1 mol·L-l的稀硫酸。

可供选用的仪器有: ①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平。
请回答下列问题:
①配制稀硫酸时,还缺少的仪器有__________、__________(写仪器名称)。
②经计算,配制480 mL l mol·L-l的稀硫酸需要用量筒量取上述浓硫酸的体积为________mL。将量取好的浓硫酸缓慢注入到盛水的烧杯后,发现量筒里还残留有浓硫酸,如果用蒸馏水洗涤后一并将洗涤液注入烧杯,将使结果浓度______(填“偏高”“偏低”或“无影响”)。
③在转入容量瓶前烧杯中液体应_______,否则会使结果浓度____(填“偏高”“偏低”或“无影响”)。
④定容时必须使溶液的凹液面与刻度线相平,若俯视会使浓度______。(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验过程可以达到实验目的的是
编号 | 实验目的 | 实验过程 |
A | 配制0.4000 mol·L1的NaOH溶液 | 称取4.0 g固体NaOH于烧杯中,加入250 mL蒸馏水溶解,然后转移至250 mL容量瓶中定容 |
B | 探究维生素C的还原性 | 向盛有2 mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化 |
C | SO42-的检验 | 先滴加BaCl2溶液再滴加HCl溶液生成白色沉淀证明原溶液中有SO42- |
D | 向某溶液中滴加氯水后再加入KSCN溶液,溶液呈红色。 | 溶液中一定含有Fe2+ |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“低碳”既是时尚,也是环保要求。“低碳”在工业生产中意义重大,充分利用原材料,不排放或减少排放“三废”,不同工厂今后联合生产等都是很好的“低碳”生产方式。下面是几个工厂利用废气、废渣(液)联合生产化肥硫酸铵的工艺:
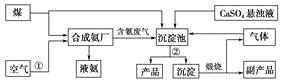
请回答下列问题:
(1)工艺操作①、②分别为____________、____________。
(2)工业合成氨的化学方程式为:__________。
(3)写出生成“产品”的离子方程式:________。
(4)在实验室中检验合成氨厂排出的废气中是否含有氨气的方法是______________。
(5)副产品的化学式为________________。该联合生产工艺中可以循环使用的物质是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气因含有少量H2S等气体开采应用受限。T.F菌在酸性溶液中可实现天然气的催化脱硫,其原理如图所示。下列说法不正确的是
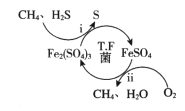
A. 该脱硫过程需要不断添加Fe2(SO4)3溶液
B. 脱硫过程O2间接氧化H2S
C. 亚铁是血红蛋白重要组成成分,FeSO4可用于治疗缺铁性贫血
D. 《华阳国志》记载“取井火煮之,一斛水得五斗盐”,我国古代已利用天然气煮盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁铝合金投入![]() 一定浓度的盐酸中,合金完全溶解。向所得溶液中滴加浓度为
一定浓度的盐酸中,合金完全溶解。向所得溶液中滴加浓度为![]() 的
的![]() 溶液,生成的沉淀跟加入的
溶液,生成的沉淀跟加入的![]() 溶液的体积关系如图。(横坐标体积单位是
溶液的体积关系如图。(横坐标体积单位是![]() ,纵坐标质量单位是g)求:
,纵坐标质量单位是g)求:
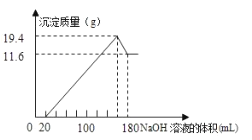
(1)合金中![]() ,
,![]() 的质量_____________
的质量_____________
(2)所用![]() 的物质的量浓度___________
的物质的量浓度___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的CO2气体通入2L未知浓度的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发),下列说法不正确的是

A.O点溶液中所含溶质的化学式为NaOH、Na2CO3
B.a点溶液中c (HCO3-) > c (CO32-)
C.标准状况下,通入CO2的体积为44.8L
D.原NaOH溶液的物质的量浓度为5mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A.水电离的c(H+)=1×10-13mol·L-1的溶液:K+、Na+、SO32-、SO42-
B.1.0mo1·L-1的CH3COOH溶液:K+、Fe3+、NO3-、Cl-
C.在![]() =l×l012的溶液:NH4+、Ca2+、Cl-、K+
=l×l012的溶液:NH4+、Ca2+、Cl-、K+
D.甲基橙显黄色的溶液:Na+、CO32-、NO3-、SO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气因含有少量H2S等气体开采应用受限。T.F菌在酸性溶液中可实现天然气的催化脱硫,其原理如图所示。下列说法不正确的是

A. 该脱硫过程需要不断添加Fe2(SO4)3溶液
B. 脱硫过程O2间接氧化H2S
C. 亚铁是血红蛋白重要组成成分,FeSO4可用于治疗缺铁性贫血
D. 《华阳国志》记载“取井火煮之,一斛水得五斗盐”,我国古代已利用天然气煮盐
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com