
下表是四种盐的溶解度(g)。
|
| 0 | 10 | 20 | 30 | 40 | 60 | 80 | 100 |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.3 | 38.4 | 39.8 |
| NaNO3 | 73 | 80 | 88 | 96 | 104 | 124 | 148 | 180 |
| KCl | 27.6 | 31 | 34.0 | 37.0 | 40.0 | 45.5 | 51.1 | 56.7 |
| KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 110.0 | 169 | 246 |
请设计一个从硝酸钠和氯化钾制备纯硝酸钾晶体的实验(要求写出化学方程式及实验步骤)。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
一定温度下,反应N2(g)+3H2(g) 2NH3(g)达到化学平衡状态的标志是( )
2NH3(g)达到化学平衡状态的标志是( )
A.N2、H2和NH3的物质的量分数不再改变
B.c(N2)∶c(H2)∶c(NH3)=1∶3∶2
C.N2与H2的物质的量之和是NH3的物质的量的2倍
D.单位时间里每增加1 mol N2,同时增加3 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
工农业及城市生活污水中含磷,家用洗涤剂是污水中磷的一个重要来源(洗涤剂中含有磷酸钠)。处理污水时要不要除去磷,下列说法中正确的是( )
A.磷是生物的营养元素,不必除去
B.含磷的污水是很好的肥料,不必除去
C.含磷的污水排到自然水中引起藻类增殖,使水变质,必须除去
D.磷对人无毒,除去与否都无关紧要
查看答案和解析>>
科目:高中化学 来源: 题型:
一定量的浓硝酸和1.92 g的铜反应,随着铜的不断减少,反应生成的气体颜色逐渐变浅,当铜反应完全时,共收集到气体1.12 L(标准状况),反应中消耗硝酸的物质的量是多少?
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
不法商贩在密闭容器中点燃硫黄对馒头进行熏制增白,食用这种馒头会大大损伤肾、肝等器官。这种对馒头增白的方法是利用了( )
A.S的漂白性 B.SO2的氧化性
C.SO2的还原性 D.SO2的漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
利用如右图所示的装置收集以下6种气体:①H2 ②Cl2 ③O2 ④HCl ⑤CO2 ⑥SO2
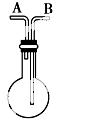 (1)若烧瓶是干燥的,则由B口进气,可收集的气体有________,若由A口进气,可收集的气体有________。
(1)若烧瓶是干燥的,则由B口进气,可收集的气体有________,若由A口进气,可收集的气体有________。
(2)若在烧瓶内充满水,可收集的气体有________,气体应由________口进入。
(3)若烧瓶中装入适量浓硫酸,可以用它来干燥的气体有_____,气体应由____口进入。
查看答案和解析>>
科目:高中化学 来源: 题型:
工厂中用稀硫酸浸泡某矿石后的溶液中,除了含有大量硫酸外,还含有少量NH4+、Fe3+、AsO43-、Cl-。为除去杂质离子,部分操作流程如下:
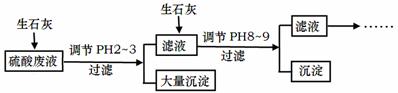
请回答问题:
(1)用稀硫酸浸泡某矿石后的溶液中,硫酸的浓度为4.9g·L-1,则该溶液中的pH约为 。
(2)NH4+在用稀硫酸浸泡某矿石后的溶液中以(NH4)2SO4和NH4Cl形式存在。现有一份(NH4)2SO4溶液,一份NH4Cl溶液,(NH4)2SO4溶液中c(NH4+)恰好是NH4Cl溶液中c(NH4+)的2倍,则c[(NH4)2SO4] c(NH4Cl)(填:<、=或>)。
(3)随着向废液中投入生石灰(忽略溶液温度的变化),溶液中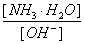 _______(填“增大”、“减小”或“不变”)。
_______(填“增大”、“减小”或“不变”)。
(4)投入生石灰调节pH到2~3时,大量沉淀主要成分为CaSO4·2H2O[含有少量Fe(OH)3],提纯CaSO4·2H2O的主要操作步骤:向沉淀中加入过量 ,充分反应后,过滤、洗涤、 。
(5)25℃, H3AsO4电离常数为K1=5.6×10-3,K2=1.7×10-7,K3=4.0×10-12。当溶液中pH调节到8~9时,沉淀主要成分为Ca3(AsO4)2。
①pH调节到8左右Ca3(AsO4)2才开始沉淀的原因是 。
②Na3AsO4第一步水解的平衡常数数值为: 。
③已知:AsO43-+2I-+2H+= AsO33-+I2+H2O ,SO2+I2+2H2O=SO42-+2I-+4H+ 。上述两个反应中还原性最强的微粒是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com