
| A. | W和X均位于第二周期 | B. | Y和Z分别是Al和Si | ||
| C. | W和X分别是O和F | D. | Z的金属性可能比X强 |
分析 W、X、Y、Z四种元素是原子序数依次增大的短周期主族元素,四种元素的电子层数之和等于10,如果W是第一周期元素,则X、Y、Z位于第三周期,且X的原子半径最大,符合题给信息,这四种元素分属于连续的四个主族,所以W是H元素、X是Mg元素、Y是Al元素、Z是Si元素;
如果W是第二周期元素,则X为第二周期、Y和Z为第三周期元素才符合四种元素的电子层数之和等于10,但原子半径最大的元素不可能为X元素,不符合题意,再结合题目分析解答.
解答 解:W、X、Y、Z四种元素是原子序数依次增大的短周期主族元素,四种元素的电子层数之和等于10,如果W是第一周期元素,则X、Y、Z位于第三周期,且X的原子半径最大,符合题给信息,这四种元素分属于连续的四个主族,所以W是H元素、X是Mg元素、Y是Al元素、Z是Si元素;
如果W是第二周期元素,则X为第二周期、Y和Z为第三周期元素才符合四种元素的电子层数之和等于10,但原子半径最大的元素不可能为X元素,不符合题意.
A.W是H元素、X是Mg元素,W位于第一周期、X位于第三周期,故A错误;
B.由上述分析可知,Y是Al元素、Z是Si元素,故B正确;
C.由上述分析可知,W、X分别是H、Mg元素,故C错误;
D.Z是Si元素,为非金属元素,X是Mg元素,所以X的金属性大,故D错误;
故选B
点评 本题考查了原子结构和元素周期律知识,熟悉元素周期表结构及原子结构是解本题关键,题目难度中等.


 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:选择题
| A. | 利用核磁共振氢谱可以鉴别乙醇和二甲醚 | |
| B. |  的一氯代物有4种 的一氯代物有4种 | |
| C. | 金刚烷( )分子中含有4个 )分子中含有4个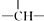 | |
| D. | 环戊二烯 (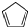 )分子中最多有9个原子在同一平面上 )分子中最多有9个原子在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
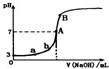
| A. | 由图可知HA是一种弱酸,且Ka=1.0×10-5 | |
| B. | 水电离出的氢离子浓度:a<b | |
| C. | 当NaOH溶液的体积为10.00mL时,有:c(A-)+c(OH-)=c(H+)+c(HA) | |
| D. | B点溶液中的离子浓度关系为:c(Na+)>c(A-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;B的水溶液不呈中性的原因NH4++H2O?NH3.H2O+H+(用离子方程式表示)
;B的水溶液不呈中性的原因NH4++H2O?NH3.H2O+H+(用离子方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0 mol•L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | 通入过量SO2气体后的溶液:H+、Ca2+、Fe3+、N03- | |
| C. | 通入足量CO2的溶液:H+、NH4+、Al3+、SO42- | |
| D. | 与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3- |
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江省哈尔滨市高三上学期期中考试化学试卷(解析版) 题型:选择题
一定条件下存在反应:CO(g)+H2O(g) CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换)密闭容器I、II、III,在I中充入1molCO和1molH2O,在II中充入1molCO2和1molH2,在III中充入2molCO和2molH2O,700℃条件下开始反应。达到平衡时,下列说法正确的是
CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换)密闭容器I、II、III,在I中充入1molCO和1molH2O,在II中充入1molCO2和1molH2,在III中充入2molCO和2molH2O,700℃条件下开始反应。达到平衡时,下列说法正确的是
A.容器I、II中正反应速率相同
B.容器I、III中反应的平衡常数相同
C.容器I中CO的物质的量比容器II中的少
D.容器I中CO的转化率与容器II中CO2的转化率之和小于1
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L1mol/L FeCl3溶液中所含Fe3+的数目为NA | |
| B. | 1mol NaHSO4晶体中所含离子的数目为2NA | |
| C. | 1mol NO2溶于足量水中,转移电子的数目为NA | |
| D. | 常温常压下,22.4L HCHO中所含σ键的数目为3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com