
| A、放热反应的反应速率一定大于吸热反应的反应速率 |
| B、熔融状态下能导电的化合物一定含离子键 |
| C、增大反应物浓度可加快反应速率,因此可用浓硫酸与铁反应增大生成氢气的速率 |
| D、在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阴极的阳极保护法 |


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
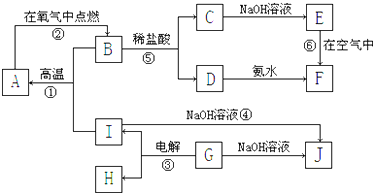
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、MgCl2溶液中加入Na的小颗粒 |
| B、CuSO4溶液中加入Na的小颗粒. |
| C、KNO3溶液中加入Na的小颗粒. |
| D、FeCl3溶液中加入Na的小颗粒 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HY水解方程式为:HY-+H2O?Y2-+H3O+ |
| B、在该盐的溶液中,离子浓度为:c(Na+)>c(HY-)>c(OH-)>c(Y2-)>c(H+) |
| C、在该盐的溶液中,离子浓度为:c(Na+)>c(Y2-)>c(HY-)>c(OH-)>c(Y2-)>c(H+) |
| D、H2Y 在电离时:H2Y+H2O?HY-+H3O+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、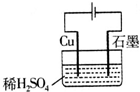 如图所示通电一段时间后,石墨电极上会有铜析出 |
| B、在原电池的负极和电解池的阴极上都发生氧化反应 |
| C、电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小 |
| D、用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定条件下,l mol N2与足量H2反应生成NH3,转移电子6NA |
| B、标准状况下,11.2 L CCl4中含有C-Cl键的数目为2NA |
| C、1 mol甲基(-14C1H3)含有的中子数和电子数分别为8NA、9NA |
| D、1 mol?L-1Na2CO3溶液中含有的钠离子总数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、液氨、氯水、王水、纯空气都是混合物 |
| B、硫酸钡、氢氧化钠、氧化钠都是强电解质 |
| C、CO2、NO2、SO2、SiO2都是酸酐 |
| D、硫酸、氢氟酸、高氯酸、都是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
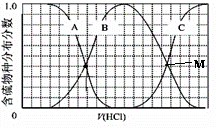 向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量.其中H2S、HS-、S2-的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图所示(忽略滴加过程H2S气体的逸出).试分析:
向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量.其中H2S、HS-、S2-的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图所示(忽略滴加过程H2S气体的逸出).试分析:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com