
| A. | 碳酸氢钠比碳酸钠热稳定强 | |
| B. | Na2O2可用作供氧剂 | |
| C. | K2FeO4具有强还原性且被氧化生成Fe3+,可用于水的消毒和净水 | |
| D. | 打磨过的铝箔在空气中受热熔化,并不滴落,说明铝与氧气没有发生化学反应 |
分析 A.碳酸氢钠受热易分解;
B.过氧化钠与水或二氧化碳反应生成氧气;
C.K2FeO4中Fe元素的化合价为+6价,具有强氧化性;
D.Al与氧气反应生成的氧化铝,熔点高.
解答 解:A.碳酸氢钠受热易分解,碳酸钠受热不分解,所以碳酸钠比碳酸氢钠的热稳定性强,故A错误;
B.过氧化钠与水或二氧化碳反应生成氧气,所以Na2O2可用作供氧剂,故B正确;
C.K2FeO4中Fe元素的化合价为+6价,具有强氧化性,被还原为Fe3+,可用于水的消毒和净水,故C错误;
D.Al与氧气反应生成的氧化铝,熔点高,包裹在Al的外面,则铝箔在空气中受热熔化,并不滴落,故D错误.
故选B.
点评 本题考查物质的性质,综合考查元素化合物和氧化还原反应知识,把握物质的性质、性质与用途的关系为解答的关键,注重基础知识的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯化钡溶液和盐酸 | B. | 硝酸银溶液和硝酸 | ||
| C. | 氯化钡溶液和硝酸银溶液 | D. | 硝酸钡溶液和硝酸银溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
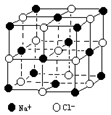 晶体具有规则的几何外形,晶体中最基本的重复单元称之为晶胞.NaCl晶体结构如图所示.
晶体具有规则的几何外形,晶体中最基本的重复单元称之为晶胞.NaCl晶体结构如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向浓氢氧化钠溶液中通入少量的CO2气体:CO2+OH-═HCO3- | |
| B. | 过量的NaHSO4溶液与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| C. | 澄清石灰水中滴加少量的小苏打溶液:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| D. | 向Na2S2O3溶液中通入过量的氯气:S2O32-+2Cl-+3H2O═2SO32-+4Cl-+6H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定有SO42- | B. | 一定有CO32- | ||
| C. | 不能确定Cl-是否存在 | D. | 不能确定SO42- 是否存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Na2O2+2H2O=4NaOH+O2↑ | B. | 2F2+2H2O=4HF+O2 | ||
| C. | 3NO2+H2O=NO+2HNO3 | D. | 3Fe+4H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$4H2+Fe3O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
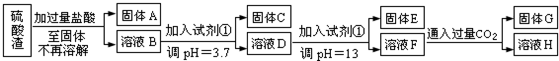
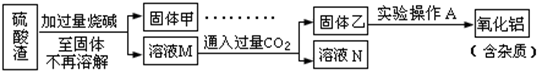
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com