
| A. | 铁 | B. | 盐酸 | C. | 氯化钠 | D. | 氢氧化钠 |
分析 Fe3+易水解,水解生成H+,配制溶液时,可加入盐酸抑制FeCl3水解,防止生成沉淀而导致溶液变浑浊.
解答 解:A.FeCl3溶液中加Fe,会 反应氧化还原反应,生成FeCl2.故A错误;
B.Fe3+易水解,水解生成H+,水解的离子方程式为Fe3++3H2O?Fe(OH)3+3H+,配制溶液时,可加入盐酸抑制FeCl3水解,防止生成沉淀而导致溶液变浑浊,故B正确;
C.加入氯化钠对FeCl3无影响,不能抑制FeCl3水解,故C错误;
D.加入氢氧化钠,NaOH与FeCl3反应生成氢氧化铁沉淀,故D错误;
故选B.
点评 本题考查盐类水解的原理及应用,题目难度不大,注意把握水解原理,学习中注重相关基础知识的积累.


科目:高中化学 来源: 题型:解答题
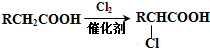
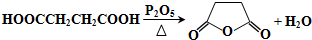
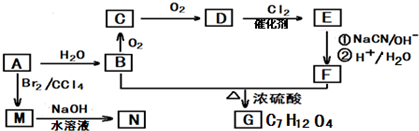
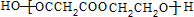 +(2n-1)H2O.
+(2n-1)H2O.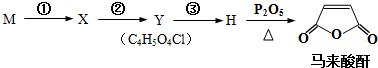
| 序号 | 所加试剂及条件 | 反应类型 |
| ② | ||
| ③ | , |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+ | B. | Ba2+ | C. | Na+ | D. | NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2015年8月12号接近午夜时分,天津滨海新区一处集装箱码头发生爆炸.发生爆炸的是集装箱内的易燃易爆物品,爆炸火光震天,并产生巨大蘑菇云.根据掌握的信息分析,装箱区的危险化学品可能有钾、钠、氯酸钠、硝酸钾、烧碱,硫化碱、硅化钙、三氯乙烯、氯碘酸等.运抵区的危险化学品可能有环己胺、二甲基二硫、甲酸、硝酸铵、氰化钠、4,6-二硝基苯-邻仲丁基苯酚等.
2015年8月12号接近午夜时分,天津滨海新区一处集装箱码头发生爆炸.发生爆炸的是集装箱内的易燃易爆物品,爆炸火光震天,并产生巨大蘑菇云.根据掌握的信息分析,装箱区的危险化学品可能有钾、钠、氯酸钠、硝酸钾、烧碱,硫化碱、硅化钙、三氯乙烯、氯碘酸等.运抵区的危险化学品可能有环己胺、二甲基二硫、甲酸、硝酸铵、氰化钠、4,6-二硝基苯-邻仲丁基苯酚等.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将水加热,Kw增大,pH不变 | |
| B. | 向水中加入少量盐酸,c(H+)增大,Kw不变 | |
| C. | 向水中加入NaOH固体,平衡逆向移动,c(OH-)降低 | |
| D. | 向水中加入AlCl3固体,平衡正向移动,c(OH-)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| CH4 | C2H4 | C3H4 | C4H10 | C5H10 | C6H10 | C7H16 |
| A. | C7H18 | B. | C7H14 | C. | C8H18 | D. | C8H16 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
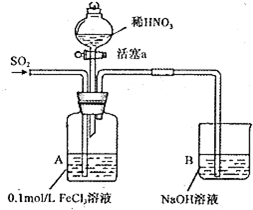
| 实验 序号 | 实验操作 | 实验现象 |
| I | 向A装置中通入一段时间的SO2气体. | A中黄色溶液最终变为浅绿色. |
| II | 取出少量A装置中的溶液,先加入 KSCN溶液,再加入BaCl2溶液. | 加人KSCN溶液后溶液不变色;再加入BaCl2溶液产生白色沉淀. |
| III | 打开活塞a,将过量稀HNO3加入装置A 中,关闭活塞a. | A中浅绿色溶液最终变为黄色. |
| V | 取出少量A装置中的溶液,加入KSCN 溶液. | 溶液变为红色. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
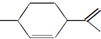 .下列关于它的说法不正确的是( )
.下列关于它的说法不正确的是( )| A. | 分子式为C10H16 | |
| B. | 1mol该有机物能与4mol H2发生加成反应 | |
| C. | 能与溴水发生加成反应 | |
| D. | 常温下呈液态,难溶于水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com