
 H++HA-,HA
H++HA-,HA H++A2-。回答以下问题:
H++A2-。回答以下问题: Ca2+(aq)+A2-(aq);ΔH>0。
Ca2+(aq)+A2-(aq);ΔH>0。 HA-,A2-浓度减小,CaA的溶解平衡向右移动,n(Ca2+)显著增大,而溶液体积变化不大,所以c(Ca2+)增大(2分)
HA-,A2-浓度减小,CaA的溶解平衡向右移动,n(Ca2+)显著增大,而溶液体积变化不大,所以c(Ca2+)增大(2分) Ca2+(aq)+CuA(s) (2分)
Ca2+(aq)+CuA(s) (2分) Ca2+(aq)+CuA(s)。
Ca2+(aq)+CuA(s)。

 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源:不详 题型:单选题
| A.c(H+)·c(OH-)比值不变 | B.溶液pH增大 |
| C.c(OH-)降低了 | D.水电离出的c(H+)增加了 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.a>b | B.b>a | C.a = b | D.无法比较 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.Ba2+、C1-、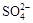 、K+ 、K+ | B.Fe3+、OH-、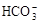 、Na+ 、Na+ |
C.Ca2+、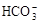 、C1-、K+ 、C1-、K+ | D.Ag+、 、Cl-、K+ 、Cl-、K+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.H+、ClO-、Ba2+、HCO3-能在水溶液中大量共存 |
| B.Mg2+、NH4+、Fe2+、NO3-能在酸性溶液中大量共存 |
| C.Fe3+、K+、SCN-、Cl-能大量共存且溶液显红色 |
| D.Na+、NO3-、CO32-、SO32-能在碱性溶液中大量共存 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 阳离子 | Na+ H+ Ba2+ |
| 阴离子 | OH- CO32- SO42- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.可以根据PbI2和AgCl的Ksp的大小比较两者的溶解能力 |
| B.常温下,同浓度的Na2S与NaHS溶液相比,NaHS溶液的pH大 |
| C.等物质的量浓度的NH4Cl溶液和NH4HSO4溶液,后者的c(NH4+)大 |
| D.能使碘化钾淀粉试纸变蓝的溶液中,Na+、S2-、Br-、NH4+等离子可以大量共存 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A. NH4+、Ag+、NO3-、Br- | B. Fe3+、H+、I-、HCO3- |
| C. K+、 Na+、 NO3-、MnO4- | D. NH4+、Na+、SO42-、OH- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用pH试纸测定氯水的pH |
| B.过滤时为了加快过滤速度,可以用玻璃棒小心搅拌 |
C.选择合适的试剂,用右图所示装置可分别制取少量CO2和O2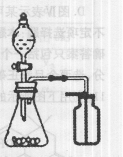 |
| D.室温下向苯和苯酚的混合溶液中加入浓溴水,充分反应后过滤,可除去苯中少量苯酚 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com