
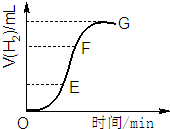
 用不纯的锌粒与2mol/L盐酸反应制取氢气气体,请回答:
用不纯的锌粒与2mol/L盐酸反应制取氢气气体,请回答:分析 (1)反应速率=$\frac{△c}{△t}$,所以曲线的斜率越大,其反应速率越快;溶液浓度、温度都增大反应速率;
(2)增加反应物浓度、增大固体表面积、以及形成原电池等都能加快反应速率;
(3)可以采用升高温度的方法加快反应速率.
解答 解:(1)反应速率=$\frac{△c}{△t}$,所以曲线的斜率越大,其反应速率越快,所以反应速率最快的是EF段;生成氢气体积等于该曲线纵坐标之差,所以生成氢气体积最大的是EF段;溶液浓度、温度都增大反应速率,因为该反应是放热反应,随着溶液的进行,溶液温度升高,溶液浓度虽然较小,但温度影响大于浓度影响,所以反应速率快,
故答案为:EF;该反应是放热反应,随着溶液的进行,溶液温度升高,溶液浓度虽然较小,但温度影响大于浓度影响,所以反应速率快;
(2)减小反应物浓度能减缓反应速率,
A.加入蒸馏水,降低酸浓度,所以反应速率减缓,故错误;
B.因为锌为固体,则加入锌粒,反应速率不变,故错误;
C.加入CuSO4溶液,锌将铜置换出来与锌形成原电池,所以反应速率加快,故正确;
D.加入6mol/L盐酸,酸浓度增大,反应速率加快,故正确;
故选CD;
(3)还可以采用升高温度的方法加快反应速率,故答案为:升高温度.
点评 本题考查化学反应速率影响因素,为高频考点,温度、浓度、催化剂、反应物接触面积等都影响反应速率,难点是(1)题图象分析,知道曲线斜率的含义.


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 海水提溴是将海水中的化合态的溴富集再转化为游离态的溴 | |
| B. | 石油裂化的主要目的是提高汽油的产量 | |
| C. | 煤干馏的产品很多,是一个化学变化 | |
| D. | 海水提镁的过程为:MgCl2(aq)$\stackrel{石灰乳}{→}$ Mg(OH)2$\stackrel{煅烧}{→}$MgO$\stackrel{电解}{→}$Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的电负性大于Y的电负性 | B. | X的原子半径大于Y的原子半径 | ||
| C. | X的氧化性大于Y的氧化性 | D. | X的第一电离能大于Y的第二电离能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
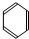 、C:CH3CH2OH D:CH3COOH
、C:CH3CH2OH D:CH3COOH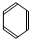 在FeBr3催化作用下,与液溴反应的化学方程式为:
在FeBr3催化作用下,与液溴反应的化学方程式为: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
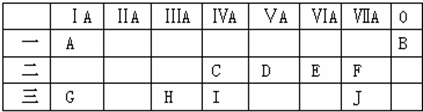
 ,元素H与元素J组成的化合物的水溶液中加入少量烧碱溶液,反应的离子方程式为Al3++3OH-=Al(OH)3↓.
,元素H与元素J组成的化合物的水溶液中加入少量烧碱溶液,反应的离子方程式为Al3++3OH-=Al(OH)3↓.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| b | |||||||||||||||||
| h | j | ||||||||||||||||
| a | c | f | i | l | m | ||||||||||||
| e | g | ||||||||||||||||
| d | k | ||||||||||||||||
| 锂 | X | Y | |
| 第一电离能 | 519 | 502 | 580 |
| 第二电离能 | 7296 | 4570 | 1820 |
| 第三电离能 | 11799 | 6920 | 2750 |
| 第四电离能 | 9550 | 11600 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应所生成的气体体积:a杯>b杯 | B. | 反应所需要的时间:a杯>b杯 | ||
| C. | 刚开始时反应的速率:b杯>a杯 | D. | 整个反应阶段平均速率:a杯>b杯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com