
| A. | 所得溶液中c(Ag+)•c(Cl-)>Ksp(AgCl) | |
| B. | 上述实验说明Cl-与NH4+间有很强的结合力 | |
| C. | 所得溶液中形成了难电离的物质 | |
| D. | 上述过程中NH3•H2O的电离常数增大 |
分析 一水合氨和溶解的AgCl反应生成络合物Ag(NH3)2OH,Ag(NH3)2OH比AgCl更难电离,据此分析解答.
解答 解:A.一水合氨和溶解的AgCl反应生成络合物Ag(NH3)2OH,故A错误;
B.反应生成Ag(NH3)2OH,说明Ag+和NH3有很强的结合力,故B错误;
C.一水合氨和溶解的AgCl反应生成络合物Ag(NH3)2OH,说明Ag(NH3)2OH比AgCl更难电离,故C正确;
D.弱电解质的电离平衡常数只与温度有关,温度不变,一水合氨电离平衡常数不变,故D错误;
故选C.
点评 本题考查难溶物的溶解平衡及电离平衡常数影响因素,侧重考查学生分析判断能力,明确AgCl和一水合氨能生成络合物是解本题关键,易错选项是D.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2FeCl3+H2S═2FeCl2+2HCl+S↓ | |
| B. | 2NH4Cl+6HCl+K2Cr2O7═2KCl+N2↑+2CrCl3+7H2O | |
| C. | 3Br2+6NaOH═NaBrO3+5NaBr+3H2O | |
| D. | 5H2S+2KMnO4+3H2SO4═K2SO4+2MnSO4+5S↓+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由硫酸铁溶液与硫酸铵溶液按一定比例混合后蒸发结晶而得 | |
| B. | 此溶液中与下列粒子可以大量共存:H+、SO42-、I-、C6H5OH | |
| C. | 此溶液中离子浓度大小关系为:SO42->Fe3+>H+>OH- | |
| D. | 将含0.1 molNH4Fe(SO4)2溶液中滴加0.1 molBa(OH)2,反应的离子方程式为:Fe3++2SO42-+2Ba2++3OH-=2BaSO4↓+Fe(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
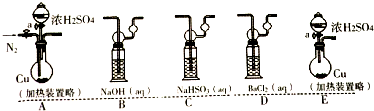
| 溶液 | ①品红溶液 | ②Na2S | ③BaCl2 | ④Ba(OH)2 | ⑤Ba(NO3)2 |
| 现象 | 溶液褪色 | 黄色沉淀 | 无明显现象 | 白色沉淀 | 白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
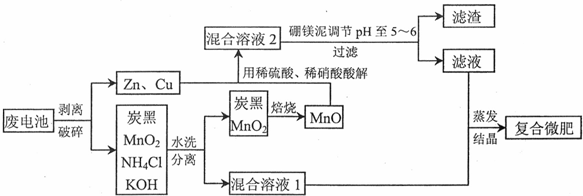
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 2NaOH+H2SO4=NaSO4+2H2O | B. | Ba(OH)2+2 HCl=BaCl2+2H2O | ||
| C. | Ba(OH)2+H2SO4=BaSO4↓+2H2O | D. | Na2CO3+H2SO4=Na2SO4+2H2O+CO2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com