
 双草酸酯(CPPO)是冷光源发光制料的主要成分,结构简式如图所示.请回答下列问题:
双草酸酯(CPPO)是冷光源发光制料的主要成分,结构简式如图所示.请回答下列问题: +4NaOH→2
+4NaOH→2 +NaOOCCOONa+2CH3CH2OH;
+NaOOCCOONa+2CH3CH2OH; ,CPPO可由芳香族化合物A和脂肪族化合物B在一定条件下合成,A的结构简式
,CPPO可由芳香族化合物A和脂肪族化合物B在一定条件下合成,A的结构简式 ,写出合成CPPO的化学方程式ClOC-COCl+2
,写出合成CPPO的化学方程式ClOC-COCl+2 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ +2HCl,该反应是有一定限度的,加入有机碱三乙胺[(C2H5)3N]能提高目标产物的产率,其原因是有机碱三乙胺能跟反应⑧的生成物HCl发生反应,使合成双草酸酯的平衡右移,;
+2HCl,该反应是有一定限度的,加入有机碱三乙胺[(C2H5)3N]能提高目标产物的产率,其原因是有机碱三乙胺能跟反应⑧的生成物HCl发生反应,使合成双草酸酯的平衡右移,; 与脂肪族化合物B可聚合成性能良好,有使用价值的树脂,写出该聚合反应的方程式n
与脂肪族化合物B可聚合成性能良好,有使用价值的树脂,写出该聚合反应的方程式n +nClOC-COCl$\stackrel{一定条件}{→}$
+nClOC-COCl$\stackrel{一定条件}{→}$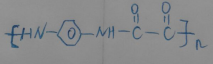 +2nHCl.
+2nHCl. 分析 (1)根据对称性原则,有几种等效氢就有集中环境的氢原子;
(2)酯基在碱性条件下水解,得到羧酸钠盐和醇,据此书写方程式;
(3)根据已知信息反应,知道B是ClOC-COCl,A是 ,根据酯的水解原理来书写水解方程式,有机碱三乙胺能跟HCl发生反应,使合成双草酸酯的平衡发生移动,根据聚合反应的特点书写
,根据酯的水解原理来书写水解方程式,有机碱三乙胺能跟HCl发生反应,使合成双草酸酯的平衡发生移动,根据聚合反应的特点书写 和ClOC-COCl之间的聚合反应方程式.
和ClOC-COCl之间的聚合反应方程式.
解答 解:(1)由CPPO的结构简式可知,CPPO分子中有3种不同化学环境的氢原子,故答案为:3;
(2)该物质与足量NaOH溶液反应的化学方程式为: +4NaOH→2
+4NaOH→2 +NaOOCCOONa+2CH3CH2OH,故答案为:
+NaOOCCOONa+2CH3CH2OH,故答案为: +4NaOH→2
+4NaOH→2 +NaOOCCOONa+2CH3CH2OH;
+NaOOCCOONa+2CH3CH2OH;
(3)根据已知信息反应,知道B是ClOC-COCl,A是 ,反应为:ClOC-COCl+2
,反应为:ClOC-COCl+2 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ +2HCl,反应有一定的限度,在D与I发生反应时加入有机碱三乙胺能提高目标产物的产率,其原因是:有机碱三乙胺能跟反应的生成物HCl发生反应,使合成双草酸酯的平衡右移,
+2HCl,反应有一定的限度,在D与I发生反应时加入有机碱三乙胺能提高目标产物的产率,其原因是:有机碱三乙胺能跟反应的生成物HCl发生反应,使合成双草酸酯的平衡右移, 和ClOC-COCl之间聚合反应的方程式为:n
和ClOC-COCl之间聚合反应的方程式为:n +nClOC-COCl$\stackrel{一定条件}{→}$
+nClOC-COCl$\stackrel{一定条件}{→}$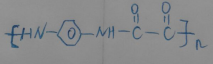 +2nHCl,
+2nHCl,
故答案为: ;ClOC-COCl+2
;ClOC-COCl+2 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ +2HCl;有机碱三乙胺能跟反应⑧的生成物HCl发生反应,使合成双草酸酯的平衡右移;n
+2HCl;有机碱三乙胺能跟反应⑧的生成物HCl发生反应,使合成双草酸酯的平衡右移;n +nClOC-COCl$\stackrel{一定条件}{→}$
+nClOC-COCl$\stackrel{一定条件}{→}$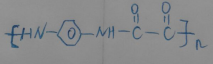 +2nHCl.
+2nHCl.
点评 本题考查有机物的推断合成,注意根据CPPO的结构采取正逆推法相结合进行推断,需要学生熟练掌握官能团的性质与转化,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | X、Y、Z、W的原子半径依次减小 | |
| B. | X与W形成的化合物中只含离子键 | |
| C. | W的氢化物的沸点一定高于Z的氢化物 | |
| D. | 若W与Y的原子序数相差5,则两者形成的化合物的化学式一定为Y2W3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验操作 | 灯泡亮度变化 |
| 通入CO2以前 | 亮 |
| 开始通入CO2时 | 亮变暗 |
| 恰好完全沉淀 | 至全暗 |
| 沉淀完全后,继续通入过量的CO2 | 暗变亮 |
| 再通入CO2 | 不变 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 结构相似的有机物不稳定,发生分子重排生成
结构相似的有机物不稳定,发生分子重排生成
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①和③ | B. | ②和④ | C. | ③和⑥ | D. | ④和⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .其合成路线如下.
.其合成路线如下.
 $\stackrel{过氧乙酸}{→}$
$\stackrel{过氧乙酸}{→}$ ②R-CH=CH-CH3$\stackrel{NBS}{→}$R-CH=CH-CH3Br
②R-CH=CH-CH3$\stackrel{NBS}{→}$R-CH=CH-CH3Br .
. .
.
 $→_{△}^{NaOH水溶液}$
$→_{△}^{NaOH水溶液}$
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com