
下列化学反应的离子方程式书写正确的是
A、把金属铁放入稀硫酸中:Fe +2 H+== Fe3++H2↑
B、往碳酸镁中滴加稀盐酸:CO32-+2 H+==CO2↑+H2O
C、氢氧化铜加到盐酸中:Cu(OH)2+2 H+== Cu 2++2 H2O
D、氢氧化钡溶液与稀硫酸反应:Ba2++ SO42-+H++OH-== Ba SO4↓ + H2O
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:


| ||
| ||
| ||
| ||
| 5 |
| 2 |
| 5 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| 5 |
| 2 |
| 5 |
| 2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源: 题型:
肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂。试回答下列问题
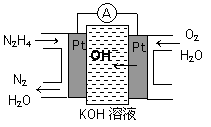
(1)肼燃料电池原理如图所示,左边电极上发生的电极反应式为_________。
(2)火箭常用N2O4作氧化剂,肼作燃料,已知:

N2(g)+2O2(g)=2NO2(g) △H =-67.7kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H =-534.0kJ·mol-1
2NO2(g)![]() N2O4(g) △H =-52.7kJ·mol-1
N2O4(g) △H =-52.7kJ·mol-1
试写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方________。
(3)联氨的工业生产常用氨和次氯酸钠为原料获得,写出反应的离子方程式为_ __。
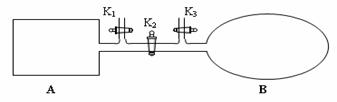
(4)如图所示,A是由易导热材料制成的体积不变的密闭容器,B是一耐化学腐蚀且易于传热的体积可变的透明气囊(体积改变过程中囊体弹力改变忽略不计)。关闭K2,将各1 mol NO2通过K1、K3分别充入A、B中,反应起始时A、B的体积相同均为a L。

①B中可通过________________判断可逆反应2NO2![]() N2O4已经达到平衡。
N2O4已经达到平衡。
②若打开K2,平衡后B容器的体积缩至0.4a L,则打开K2之前,气球B体积为______L。
③若容器A中到达平衡所需时间t s,达到平衡后容器内压强为起始压强的0.8倍,则 平均化学反应速率v(NO2)等于____________________(用含a、t的代数式表示)。
④若平衡后在A容器中再充入0.5mol NO2,则重新到达平衡后,平衡混合气中NO2的体积分数_______________(填 “变大”“变小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂。试回答下列问题
(1)肼燃料电池原理如图所示,左边电极上发生的电极反应式为_________。
(2)火箭常用N2O4作氧化剂,肼作燃料,已知:
N2(g)+2O2(g)=2NO2(g) △H =-67.7kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H =-534.0kJ·mol-1
2NO2(g)![]() N2O4(g) △H =-52.7kJ·mol-1
N2O4(g) △H =-52.7kJ·mol-1
试写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方________。
(3)联氨的工业生产常用氨和次氯酸钠为原料获得,写出反应的离子方程式为_ __。
(4)如图所示,A是由易导热材料制成的体积不变的密闭容器,B是一耐化学腐蚀且易于传热的体积可变的透明气囊(体积改变过程中囊体弹力改变忽略不计)。关闭K2,将各1 mol NO2通过K1、K3分别充入A、B中,反应起始时A、B的体积相同均为a L。
①B中可通过________________判断可逆反应2NO2![]() N2O4已经达到平衡。
N2O4已经达到平衡。
②若打开K2,平衡后B容器的体积缩至0.4a L,则打开K2之前,气球B体积为______L。
③若容器A中到达平衡所需时间t s,达到平衡后容器内压强为起始压强的0.8倍,则 平均化学反应速率v(NO2)等于____________________(用含a、t的代数式表示)。
④若平衡后在A容器中再充入0.5mol NO2,则重新到达平衡后,平衡混合气中NO2的体积分数_______________(填 “变大”“变小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com