
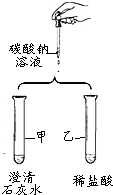
 如图是某小组验证碳酸钠性质的实验方案.
如图是某小组验证碳酸钠性质的实验方案.| 实验步骤 | 实验现象 | 结论 |
| 取少量的废液于试管中,滴加2~3滴石蕊试液,振荡. | 无现象 | 废液的pH=7; 猜想Ⅰ成立. |
分析 (1)甲试管中是碳酸钠和石灰水反应生成碳酸钙沉淀和氢氧化钠,依据化学方程式书写原则书写;
(2)根据盐酸与碳酸钠反应现象分析,乙试管中盐酸与碳酸钠反应产生二氧化碳,
【设计实验】甲试管中一定有氢氧化钠和碳酸钙,可能含有氢氧化钙或碳酸钠,乙试管中一定有氯化钠,可能含有盐酸或碳酸钠,将两试管中废液倒入废液缸,废液澄清,说明盐酸一定过量,若没有盐酸,则废液中一定含有碳酸钙,废液是浑浊的.盐酸过量时,盐酸与碳酸钙反应生成氯化钙,与氢氧化钠反应生成氯化钠,和氢氧化钙反应生成氯化钙,因此废液中可能含有的溶质为Ⅰ.CaCl2、NaClⅡ.CaCl2、NaCl、HCl;是否有盐酸可以用石蕊试液检验.
解答 解:(1)甲试管中是碳酸钠和石灰水反应生成碳酸钙沉淀和氢氧化钠,化学方程式为:Na2CO3+Ca(OH)2═2NaOH+CaCO3↓,
故答案为:Na2CO3+Ca(OH)2═2NaOH+CaCO3↓;
(2)乙试管中盐酸与碳酸钠反应产生二氧化碳,因此看到大量气泡,故答案为:大量气泡;
【设计实验】甲试管中一定有氢氧化钠和碳酸钙,可能含有氢氧化钙或碳酸钠,乙试管中一定有氯化钠,可能含有盐酸或碳酸钠,将两试管中废液倒入废液缸,废液澄清,说明盐酸一定过量,若没有盐酸,则废液中一定含有碳酸钙,废液是浑浊的.盐酸过量时,盐酸与碳酸钙反应生成氯化钙,与氢氧化钠反应生成氯化钠,和氢氧化钙反应生成氯化钙,因此废液中可能含有的溶质为Ⅰ.CaCl2、NaClⅡ.CaCl2、NaCl、HCl,要验证盐酸是否剩余,根据盐酸的化学性质,可取废液少量于试管滴加紫色石蕊试液,若变红则含有盐酸,若无现象则证明无HCl,可能Ⅰ.CaCl2、NaCl正确,如果废液是浑浊的,过滤后滤液中肯定没有物质是HCl,
故答案为:
| 石蕊 | =,Ⅰ |
点评 本题考查了物质组成和性质的探究,根据反应物的过量情况,反应会出现多种结果,据此对反应后的生成物的可能组成进行猜想,然后根据酸的性质设计实验进行验证,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
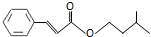
| A. | 不能使溴的四氯化碳溶液褪色 | |
| B. | 能与新制的Cu(OH)2共热生成红色沉淀 | |
| C. | 能与热的浓硝酸和浓硫酸混合液反应 | |
| D. | 能与FeCl3溶液反应显紫色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
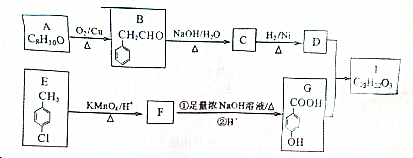
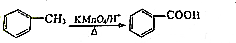
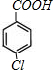 +3 NaOH$\stackrel{△}{→}$
+3 NaOH$\stackrel{△}{→}$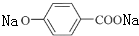 +NaCl+2H2O.
+NaCl+2H2O.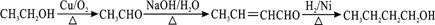 (无机试剂任用).合成路线流程图示例如下:
(无机试剂任用).合成路线流程图示例如下: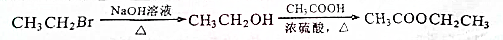
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因浓硫酸具有强氧化性,故不可用它来干燥氢气 | |
| B. | 浓硫酸不活泼,可用铁铝容器存放 | |
| C. | 浓硫酸有强氧化性,稀硫酸没有氧化性 | |
| D. | 浓硫酸难挥发,可用来制HF、HCl等挥发性酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30℃ | B. | 35℃ | C. | 40℃ | D. | 45℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
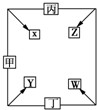 甲、乙、丙、丁四种单质在点燃条件下反应生成X、Y、Z、W四种化合物,其转化关系如图所示.又如:
甲、乙、丙、丁四种单质在点燃条件下反应生成X、Y、Z、W四种化合物,其转化关系如图所示.又如:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .C2A4的水溶液呈碱(填“酸”“碱”或“中”)性,1mol C2A4最多可以与2mol HCl或NaOH发生中和反应生成正盐.C2A4 和A2D2 既具有氧化性,又具有还原性,从化合价的角度解释C2A4 和A2D2 既具有氧化性又具有还原性的原因N2H4中N显-2,H2O2中O显-1,均为相应元素的中间价态,所以既有氧化性,又有还原性
.C2A4的水溶液呈碱(填“酸”“碱”或“中”)性,1mol C2A4最多可以与2mol HCl或NaOH发生中和反应生成正盐.C2A4 和A2D2 既具有氧化性,又具有还原性,从化合价的角度解释C2A4 和A2D2 既具有氧化性又具有还原性的原因N2H4中N显-2,H2O2中O显-1,均为相应元素的中间价态,所以既有氧化性,又有还原性 ,该化合物与CA3和A2D的熔点由高到低的顺序为H2O>NH3>CH4(用化学式表示).
,该化合物与CA3和A2D的熔点由高到低的顺序为H2O>NH3>CH4(用化学式表示). .CA3、A2D、EA3的热稳定性由强到弱的顺序为H2O>NH3>PH3(用化学式表示).
.CA3、A2D、EA3的热稳定性由强到弱的顺序为H2O>NH3>PH3(用化学式表示).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡 常数 | K1 | 1.8×10-5 | 4.2×10-7 | 3.0×10-8 |
| K2 | 5.6×10-11 | -- | ||
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NaHCO3 HCl | B. | Na2CO3 HCl | C. | AlCl3 NaOH | D. | CaCl2 Na2CO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com