
向一体积为2 L的恒容密闭容器里充入1 mol N2和4 mol H2,在一定温度下发生反应:N2(g)+3H2(g)  2NH3(g);ΔH<0。10秒时达到平衡,c(NH3)为0.4 mol/L。下列说法正确的是( )
2NH3(g);ΔH<0。10秒时达到平衡,c(NH3)为0.4 mol/L。下列说法正确的是( )
A.该反应达平衡时H2的转化率为30%
B.降低温度能使混合气体的密度增大
C.向该容器中充入N2,平衡正向移动
D.研发高效催化剂可大大提高N2的转化率
科目:高中化学 来源: 题型:
配制100 mL 0.1 mol·L-1Na2CO3溶液,下列操作正确的是
A.称取1.06 g无水碳酸钠,加入100 mL容量瓶中,加水溶解、定容
B.称取1.06 g无水碳酸钠,加入100 mL蒸馏水,搅拌、溶解
C.转移Na2CO3溶液时,未用玻璃棒引流,直接倒入容量瓶中
D.定容后,塞好瓶塞,反复倒转,摇匀
查看答案和解析>>
科目:高中化学 来源: 题型:
设阿伏加德罗常数的符号为NA,标准状况下某种O2和N2的混合气体m g,含有b个分子,则ng该混合气体在相同状况下所占的体积(L)应是
A.
 B.
B. C.
C. D.
D.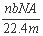
查看答案和解析>>
科目:高中化学 来源: 题型:
对于密闭容器中的可逆反应:mX(g)+nY(s)  pZ(g) ΔH<0,达化学平衡后,改变条件,下列表述不正确的是( )
pZ(g) ΔH<0,达化学平衡后,改变条件,下列表述不正确的是( )
A.增大压强,化学平衡不一定发生移动
B.通入氦气,化学平衡不一定发生移动
C.增加X或Y的物质的量,化学平衡一定发生移动
D.其他条件不变,升高温度,化学平衡一定发生移动
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,容积相同的两个密闭容器中,一个充入2 mol SO2、1 mol O2,另一个充入2 mol SO3,发生反应2SO2(g)+O2(g)  2SO3(g);ΔH=-196.6 kJ/mol时,下列六种说法中正确的有( )
2SO3(g);ΔH=-196.6 kJ/mol时,下列六种说法中正确的有( )
①二氧化硫的转化率与三氧化硫的分解率之和为1
②达到平衡所需的时间相等 ③密度相等 ④压强相等
⑤放出与吸收的热量相等 ⑥二氧化硫的浓度相同
A.3种 B.4种
C.5种 D.6种
查看答案和解析>>
科目:高中化学 来源: 题型:
反应aA(g)+bB(g)  cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图所示:
cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图所示:

回答问题:
(1)反应的化学方程式中,a∶b∶c为________;
(2)A的平均反应速率vⅠ(A)、vⅡ(A)、vⅢ(A)从大到小排列次序为________;
(3)B的平衡转化率αⅠ(B)、αⅡ(B)、αⅢ(B)中最小的是________,其值是________;
(4)由第一次平衡到第二次平衡,平衡移动的方向是__________,采取的措施是__________________;
(5)比较第Ⅱ阶段反应温度(T2)和第Ⅲ阶段反应温度(T3)的高低:T2________T3(填“>”、“<”、“=”),判断的理由是__________________________;
(6)达到第三次平衡后,将容器的体积扩大一倍,假定10 min 后达到新的平衡,请在下图中用曲线表示第Ⅳ阶段体系中各物质的浓度随时间变化的趋势(曲线上必须标出A、B、C)。

查看答案和解析>>
科目:高中化学 来源: 题型:
表中物质的分类组合完全正确的是
| 编号 | A | B | C | D |
| 强电解质 | Ba(OH)2 | 盐酸 | HClO4 | BaSO4 |
| 弱电解质 | HI | CaCO3 | HClO | NH3·H2O |
| 非电解质 | SO2 | NH3 | Cl2 | 乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:
为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏。化学家研究在催化剂作用下,通过下列反应:CCl4+H2 CHCl3+HCl使CCl4转
CHCl3+HCl使CCl4转 化为重要的化工原料氯仿(CHCl3)。此反应伴随有副反应,会生成CH2Cl2、CH3Cl
化为重要的化工原料氯仿(CHCl3)。此反应伴随有副反应,会生成CH2Cl2、CH3Cl 和CH4等。已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃。
和CH4等。已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃。
(1)在密闭容器中,该反应达到平衡状态后,测得如下数据(假设不考虑副反应)。
| 实验序号 | 温度℃ | 初始CCl4浓度(mol/L) | 初始H2浓度(mol/L) | CCl4的平衡转化率 |
| 1 | 110 | 0.8 | 1.2 | A |
| 2 | 110 | 1 | 1 | 50% |
| 3 | 100 | 1 | 1 | B |
①此反应的化学平衡常数表达式为________________,在110℃时平衡常数为____________。
②实验1中,CCl4的转化率A__________50%(填“大于”、“小于”或“等于”)。
③实验2中,10 h后达到平衡,H2的平均反应速率为__________。
④实验3中,B的值________(选填序号)。
A.等于50% B.大于50%
C.小于50% D.从本题资料无法判断
(2)120℃时,在相同条件的密闭容器中,分别进行H2的初始浓度为2 mol/L和4 mol/L的实验,测得反应消耗CCl4的百分率(x%)和生成物中CHCl3的百分含量(y%)随时间(t)的变化关系如图(图中实线是消耗CCl4的百分率变化曲线,虚线是产物中CHCl3的百分含量变化曲线)。

①在图中的四条线中,表示H2起始浓度为2 mol/L的实验消耗CCl4的百分率变化曲线是________(选填序号)。
②根据上图曲线,氢气的起始浓度为________ mol/L时,有利于提高CCl4的平衡转化率和产物中CHCl3的百分含量。你判断的依据是____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com