
| A. | 0.2mol•L-1 Na2SO4溶液中含有0.4NA个Na | |
| B. | 在标准状况下,NA个C02分子与NA个H2SO4分子所占的体积之比为1:1 | |
| C. | 5.6g铁在足量氯气中燃烧时失去的电子数目为0.2NA | |
| D. | 常温常压下,64g SO2中含有的原子数为3NA |
分析 A、溶液体积不明确;
B、标况下,硫酸为液体;
C、求出铁的物质的量,然后根据铁和氯气反应后变为+3价来分析;
D、求出二氧化硫的物质的量,然后根据1mol二氧化硫中含2mol氧原子来分析.
解答 解:A、溶液体积不明确,故溶液中的钠离子的个数无法求算,故A错误;
B、标况下,硫酸为液体,故NA个H2SO4分子即1mol硫酸的体积小于22.4L,而NA个C02分子即1mol二氧化碳的体积为22.4L,故B错误;
C、5.6g铁的物质的量为0.1mol,而铁和氯气反应后变为+3价,故0.1mol铁与氯气反应后失去0.3mol电子,即0.3NA个,故C错误;
D、64g二氧化硫的物质的量n=$\frac{64g}{64g/mol}$=1mol,而1mol二氧化硫中含3mol原子,即3NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,注意把握公式的使用和物质的结构,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 第VIIA族元素由上至下其单质的沸点依次升高 | |
| B. | 第VIA族元素的最高化合价都为+6价 | |
| C. | 离核越远的电子层上的电子能量越低 | |
| D. | 所有元素的原子中都含有中子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 用稀硫酸代替AgNO3溶液,也可形成原电池 | |
| B. | 银片为负极,发生的反应为:Ag++e-=Ag | |
| C. | 进行实验时,琼脂中K+移向Mg(NO3)2溶液 | |
| D. | 取出盐桥,电流表依然有偏转 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 每生成2分子AB吸收bkJ热量 | |
| B. | 该反应中反应物的总能量高于生成物的总能量 | |
| C. | 断裂1molA-A键和1molB-B键,放出a kJ能量 | |
| D. | 该反应焓变为△H=+(a-b) kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的比例模型: | B. | 氯离子的结构示意图: | ||
| C. | 溴原子的价层电子排布式:4s24p5 | D. | 过氧化钠的电子式: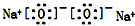 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com