
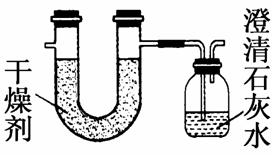
已知某种燃料含有碳、氢、氧三种元素。为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的O2中燃烧,并将产生的气体全部通过图示装置,得到如表所列的实验数据(产生的气体完全被吸收)。
| 实验前 | 实验后 | |
| (干燥剂+U形管)的质量 | 101.1 g | 102.9 g |
| (澄清石灰水+广口瓶)的质量 | 312.0 g | 314.2 g |
根据实验数据填空:
(1)实验完毕后,生成物中水的质量为________ g,假设广口瓶里生成一种正盐,其质量为________ g。
(2)生成的水中氢元素的质量为________ g。
(3)生成的CO2中碳元素的质量为________ g。
(4)该燃料中碳、氢元素质量比为________。
 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:
下列溶液,一定呈中性的是 ( )
A.由等体积、等物质的量浓度的一元酸跟NaOH溶液混合后所形成的溶液
B.c(H+)=1.0×10-7mol·L-1的溶液
C.pH=7的溶液
D.c(H+)=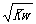 的溶液(Kw为该温度下水的离子积常数)
的溶液(Kw为该温度下水的离子积常数)
查看答案和解析>>
科目:高中化学 来源: 题型:
向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系如右图所示。则下列离子组在对应的溶液中一定能大量共存的是
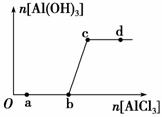
A.a点对应的溶液中:Na+、Fe3+、SO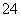 、HCO
、HCO
B.b点对应的溶液中:Na+、S2-、SO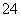 、Cl-
、Cl-
C.c点对应的溶液中:Ag+、Ca2+ 、NO
、NO 、F-
、F-
D.d点对应的溶液中:K+、NH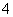 、I-、CO
、I-、CO
查看答案和解析>>
科目:高中化学 来源: 题型:
2-氨基-5硝基苯甲醚俗称红色基B,主要用于绵纤维织物的染色,也用于制金黄、枣红、黑等有机颜料,其结构简式为: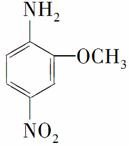 ,若分子式与红色基B相同,且氨基(—NH2)与硝基(—NO2)直接连在苯环上并呈对位时的同分异构体数目(包括红色基B)可能有( )
,若分子式与红色基B相同,且氨基(—NH2)与硝基(—NO2)直接连在苯环上并呈对位时的同分异构体数目(包括红色基B)可能有( )
A.2种 B.4种
C.6种 D.10种
查看答案和解析>>
科目:高中化学 来源: 题型:
某地在整顿音像市场的活动中,查获了一大批盗版光盘,并进行了“绿色销毁”。以下做法中,属于“绿色销毁”的是( )
A.泼上汽油焚烧
B.倾倒入江河中
C.深埋于土中
D.碾压粉碎后再回收利用
查看答案和解析>>
科目:高中化学 来源: 题型:
斯坦福大学B.M.Trost教授提出了绿色化学的核心概念——原子经济性。我们常用原子利用率来衡量化学反应过程的原子经济性,其计算公式为:原子利用率=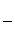 ×100%
×100%
下面是新型自来水消毒剂ClO2的四种生产方法,请填空:
(1)氯酸钠和盐酸法:本方法的方程式为2NaClO3+4HCl 2NaCl+2ClO2↑+Cl2↑+2H2O,此方法的原子利用率为________%(保留一位小数,下同)。
2NaCl+2ClO2↑+Cl2↑+2H2O,此方法的原子利用率为________%(保留一位小数,下同)。
(2)电解亚氯酸钠法:本方法是用惰性电极电解亚氯酸钠溶液,原子利用率为62.2%,其阳极电极反应式为:ClO -e-
-e- ClO2,阴极电极反应式为_______________。
ClO2,阴极电极反应式为_______________。
(3)亚氯酸钠和氯气法:本方法的原子利用率为53.6%,此反应的化学方程式为____________________。
(4)联合工艺法:本方法的反应原理由三步组成:
①电解氯化钠溶液NaCl+3H2O NaClO3+3H2↑
NaClO3+3H2↑
②氢气和氯气合成氯化氢
③生成二氧化氯2NaClO3+4HCl 2NaCl+2ClO2↑+Cl2↑+2H2O此方法的原子利用率最大为________%。
2NaCl+2ClO2↑+Cl2↑+2H2O此方法的原子利用率最大为________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
某一元弱酸(用HA表示)在水中的电离方程式是:HA H++A-,回答下列问题:
H++A-,回答下列问题:
(1)向溶液中加入适量NaA固体,以上平衡将向________(填“正”、“逆”)反应方向移动,理由是________________________________。
(2)若向溶液中加入适量NaCl溶液,以上平衡将向________(填“正”、“逆”)反应方向移动,溶液中c(A-)将________(填“增大”、“减小”或“不变”),溶液中c(OH-)将________(填“增大”、“减小”或“不变”)。
(3)在25℃下,将a mol/L的氨水与0.01 mol/L的盐酸等体积混合,反应平衡时溶液中c(NH )=c(Cl-),则溶液显________性(填“酸”、“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=____________。
)=c(Cl-),则溶液显________性(填“酸”、“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3―→K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75 mol,则下列判 断正确的是
断正确的是
A.生成40.0 L N2(标准状况)
B.有0.250 mol KNO3被氧化
C.转移电子的物质的量为1.25 mol
D.被氧化的N原子的物质的量为3.75 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com