
| A. | Z为0.3 mol•L-1 | |
| B. | X2为0.15 mol•L-1,Z为0.1 mol•L-1 | |
| C. | c(X2)+c(Y2)+c(Z)=0.6 mol•L-1 | |
| D. | c(X2)+c(Y2)+c(Z)=0.55 mol•L-1 |
分析 化学平衡的建立,既可以从正反应开始,也可以从逆反应开始,或者从正逆反应开始,不论从哪个方向开始,物质都不能完全反应,若反应向正反应进行到达平衡,X2、Y2的浓度最小,Z的浓度最大,若反应逆正反应进行到达平衡,X2、Y2的浓度最大,Z的浓度最小,利用极限法假设完全反应,计算出相应物质的浓度变化量,实际变化量小于极限值,据此判断分析.
解答 解:若反应向正反应进行到达平衡,X2、Y2的浓度最小,Z的浓度最大,假定完全反应,则:
X2(气)+Y2(气)?2Z(气),
开始(mol/L):0.1 0.3 0.2
变化(mol/L):0.1 0.1 0.2
平衡(mol/L):0 0.2 0.4
若反应逆正反应进行到达平衡,X2、Y2的浓度最大,Z的浓度最小,假定完全反应,则:
X2(气)+Y2(气)?2Z(气),
开始(mol/L):0.1 0.3 0.2
变化(mol/L):0.1 0.1 0.2
平衡(mol/L):0.2 0.4 0
由于为可逆反应,物质不能完全转化所以平衡时浓度范围为0<c(X2)<0.2,0.2<c(Y2)<0.4,0<c(Z)<0.4,
又反应前后物质的量不变,所以三种物质的浓度之和一直等于0.6mol/L,故ABC正确、D错误.
故选D.
点评 本题考查了化学平衡的建立,难度不大,关键是利用可逆反应的不完全性,运用极限假设法解答,假设法是解化学习题的常用方法.


科目:高中化学 来源: 题型:选择题
| A. | Fe(OH)2溶于稀硝酸中 Fe(OH)2+3H+=Fe2++3H2O | |
| B. | H218O中投入Na2O2固体 2H218O+2O22-=4OH-+18O2↑ | |
| C. | 铝片跟氢氧化钠溶液反应:Al+2OH-=AlO2-+H2↑ | |
| D. | 等体积等物质的量浓度的Ba(OH)2溶液与明矾溶液混合3Ba2++6OH-+2Al3++3SO42-=3BaSO4↓+2Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
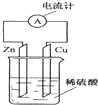
| A. | 电子由铜片通过导线流向锌片 | B. | 锌片逐渐溶解 | ||
| C. | 烧杯中溶液逐渐呈蓝色 | D. | 该装置能将电能转变为化学能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室用浓盐酸与MnO2反应制Cl2:MnO2+2H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+Mn2++H2O | |
| B. | 澄清石灰水与少量苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| C. | 碳酸钙溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | 氯化亚铁溶液中通入氯气:2Fe2++Cl2═2Fe3++2Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com