
Ⅰ 能源短缺是人类面临的重大问题。甲醇是一种可再生能源.具有广泛的开发和应用前景。因此甲醇被称为21世纪的新型燃料。
(1)已知在常温常压下:
①2CH3OH(l)十3O2(g) 2CO2(g)+4H2O(g) △H=—1275.6 kJ·mol—1
②H2O(l) H2O(g) △H=+44.0 kJ.mol-1
写出表示甲醇燃烧热的热化学方程式 。
(2)某种甲醇—空气燃料电池是采用铂作为电极,稀硫酸作电解质溶液。其工作时负极的电极反应式可表示为 。
Ⅱ 甲烷也是一种清洁燃料,但不完全燃烧时热效率降低并会产生有毒气体造成污染。
已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=―890.3kJ/mol
2CO(g)+O2(g)=2CO2(g) ΔH2=―566.0kJ/mol
(3)则甲烷不完全燃烧生成一氧化碳和液态水时的热效率只是完全燃烧时的________倍(计算结果保留1位小数)。
(4)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解50 mL 2 mol/L的氯化铜溶液的装置示意图:
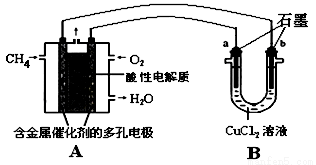
请回答:当线路中有0.1 mol电子通过时,________(填“a”或“b”)极增重________g。
科目:高中化学 来源:2016-2017学年山东省高二上期中化学卷(解析版) 题型:选择题
某温度下,在固定容积的密闭容器中,可逆反应A(g)+3B(g) 2C(g)达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1。保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则:
2C(g)达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1。保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则:
A.平衡不移动
B.再达平衡时,n(A)∶n(B)∶n(C)仍为2∶2∶1
C.再达平衡时,C的体积分数增大
D.再达平衡时,正反应速率增大,逆反应速率减小
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高一12月月考化学卷(解析版) 题型:选择题
下列反应的离子方程式书写正确的是
A.氯化铝溶液中加入过量氨水:Al3++4NH3•H2O=AlO2-+4NH4++2H2O
B. 铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑
铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑
C.碳酸钙溶于醋酸:CaCO3+2H+=Ca2++CO2↑+H2O
D.氯化亚铁溶液中通入氯气:2Fe2++Cl2=2Fe3++2Cl-
查看答案和解析>>
科目:高中化学 来源:2017届福建省四地六校高三上学期12月月考化学试卷(解析版) 题型:选择题
X、Y、Z、W均为短周期元素,原子序数依次增大。Y原子的M电子层有1个电子,同周期的简单离子的半径中Z最小。W与X同主族,其最高化合价是最低负化合价绝对值的3倍。下列说法正确的是( )
A. 原子半径的大小:W > Z> Y
B. 简单气态氢化物的热稳定性: W > X
C. Y、Z、W最高价氧化物对应水化物能够两两发生反应
D. 简单离子的还原性:X> W
查看答案和解析>>
科目:高中化学 来源:2017届福建省四地六校高三上学期12月月考化学试卷(解析版) 题型:选择题
化学与人类生活、生产和社会可持续发展密切相关。下列说法正确的是( )
A.往自来水中加入明矾进行杀菌消毒
B.氮化硅陶瓷是一种新型的无机非金属材料
C.在食品袋中放入硅胶、生石灰的透气小袋,可防止食物受潮、氧化变质
D.为提高农作物的产量和质量,应大量使用化肥和农药
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上学期第二次月考化学试卷(解析版) 题型:选择题
根据图,下列判断中正确的是
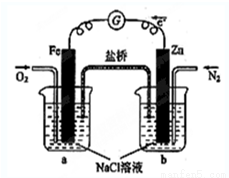
A.向烧杯a中加入少量KOH溶液,有白色沉淀生成
B.烧杯b中发生反应为2Zn-4eˉ=2Zn2+
C.电子从Zn极流出,流入Fe极,经盐桥回到Zn极
D.烧杯a中发生反应O2 + 4H++ 4eˉ= 2H2O,溶液pH降低
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上学期第二次月考化学试卷(解析版) 题型:选择题
关于下列各实验装置的叙述中,不正确的是

A.装置①可用于分离CH3CHO和H2O的混合物
B.装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体
C.装置③中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸
D.装置④可用于干燥、收集NH3,并吸收多余的NH3
查看答案和解析>>
科目:高中化学 来源:2016-2017陕西西安长安区一中重点班高一12月考化学卷(解析版) 题型:选择题
为测定气球内的气体成分,有学生用超薄材料的气球按图装置进行实验。开始时气球沉于烧杯底部,打开开关后,过一会儿气球从烧杯底部慢慢浮起,最后悬于烧杯口。气球内可能的气体是( )
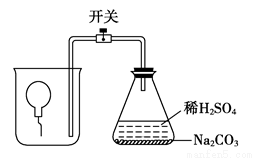
A.氧气 B.氢气 C.甲烷 D.氯气
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高二上期中化学试卷(解析版) 题型:填空题
过氧化氢和臭氧是用途很广的氧化剂。试回答下列问题:
(1)过氧化氢是一种绿色氧化剂,写出在酸性条件下H2O2氧化KI的离子反应方程式:________________
(2)Na2O2 、K2O2、 以及BaO2都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,过滤即可制得。最适合的过氧化物是___________(写电子式),
(3)火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢为助燃剂.
已知:N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=-534kJ mol-1
H2O2(l)=H2O(l)+1/2O2(g) △H=-98.64kJ mol-1
H2O(l)=H2O(g) △H=+44kJ mol-1
则反应N2H4(g)+2H2O2(l)= N2(g)+4H2O(g) 的 △H=____________
(4)臭氧(O3)可以使湿润的淀粉-碘化钾试纸变蓝,反应的化学方程式为:____________________
KI+O3+H2O→KOH+I2+O2(未配平)回答问题:
还原产物的化学式为________________
②配平后的化学方程式是____________________
(4)O3 可由臭氧发生器(原理如图8所示)电解稀硫酸制得。

①图中阴极为 (填“A”或“B”)。
②若C处不通入O 2 ,D、E处分别收集到11.2L和有4.48L气体(标准状况下), 则E处收集的气体中O3所占的体积分数为 (忽略 O 3 的分解)。
③若C处通入O 2,则A极的电极反应式为: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com