
| A. | 每生成55 g K2S转移电子数为6.02×1023 | |
| B. | S和KNO3均为还原剂 | |
| C. | 反应过程中氮元素被还原 | |
| D. | CO2为还原产物 |
分析 反应2KNO3+3C+S═K2S+N2↑+3CO2↑中,N和S元素化合价降低,被还原,S和KNO3为氧化剂,C元素化合价升高,被氧化,C为还原剂,结合化合价的变化判断电子转移的数目.
解答 解:A.n(K2S)=$\frac{55g}{110g/mol}$=0.5mol,消耗1.5molC,转移电子的物质的量为1.5mol×4=6mol,转移电子的数目为6×6.02×1023,故A错误;
B.N和S元素化合价降低,被还原,S和KNO3为氧化剂,故B错误;
C.反应过程中N元素的化合价降低,被还原,故C正确;
D.C元素化合价升高,被氧化,C为还原剂,CO2为氧化产物,故D错误.
故选C.
点评 本题考查氧化还原反应,题目难度不大,本题注意把握元素化合价的变化,从化合价的角度理解氧化还原反应.


 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2通入水中:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 硫酸铝溶液与过量氨水反应:Al3++3NH3•H2O═3NH${\;}_{4}^{+}$+Al(OH)3↓ | |
| C. | 实验室用石灰石和盐酸反应制取 CO2:CO${\;}_{3}^{2-}$+2H+═CO2+H2O | |
| D. | 向Na2SO3溶液中加入稀硝酸:SO${\;}_{3}^{2-}$+2H+═SO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将5.85gNaCl晶体溶入100mL水中,制得0.1mol/L的NaCl溶液 | |
| B. | 将25g无水CuSO4溶于水制成100mL溶液,其浓度为1mol/L | |
| C. | 将wg a%的NaCl溶液蒸发掉$\frac{w}{2}$g水,得到2a%的NaCl溶液 | |
| D. | 将1体积c1mol/L的硫酸用4体积水稀释,稀溶液的浓度为0.2c1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、NO${\;}_{3}^{-}$、AlO${\;}_{2}^{-}$、SO${\;}_{4}^{2-}$ | B. | Na+、Al3+、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$ | ||
| C. | K+、Cl-、AlO${\;}_{2}^{-}$、CO${\;}_{3}^{2-}$ | D. | Na+、Mg2+、Cl-、HCO${\;}_{3}^{-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉、纤维素、油脂、蛋白质都属于天然有机高分子化合物 | |
| B. | 实验室只用乙醇和乙酸混合加热就可以制得乙酸乙酯 | |
| C. | 可利用新制的氢氧化铜悬浊液检验尿液中的葡萄糖 | |
| D. | CH3CH2CH(CH3)CH3与CH3CH(CH3)CH2CH3互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
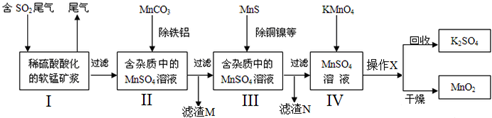
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com