
【题目】不能用离子方程式 CO ![]() +2H+=CO2↑+H2O表示的反应是( )
+2H+=CO2↑+H2O表示的反应是( )
A.Na2CO3+2HCl=2NaCl+CO2↑+H2O
B.K2CO3+2HNO3=2KNO3+CO2↑+H2O
C.K2CO3+H2SO4=K2SO4+CO2↑+H2O
D.CaCO3+2HCl=CaCl2+CO2↑+H2O
 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:高中化学 来源: 题型:
【题目】化合物J具有抗缺血性脑损伤的作用,合成J的一种路线如图: 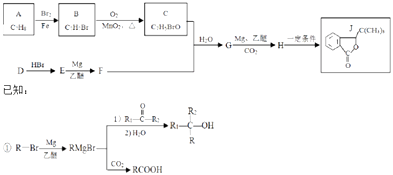
②E的核磁共振氢谱只有一组峰
③C能发生银镜反应
回答下列问题:
(1)D所含有官能团的名称 .
(2)由D生成E的化学方程式为 , 其反应类型为 .
(3)G的结构简式为 .
(4)C的某同系物X,相对分子质量比C大14,X的结构有种,其中核磁共振氢谱为4组峰,且锋面积比为1:2:2:2的是(写结构简式).
(5)由甲醛和化合物A经下列步骤可得到2﹣苯基乙醇. ![]()
反应条件1为;反应条件2所选择的试剂为;L的结构简式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学反应速率的说法中正确的是
A. 化学反应速率可用某时刻生成物的物质的量来表示
B. 在同一反应中,用反应物或生成物表示的化学反应速率的值是相等的
C. 化学反应速率是指反应进行的时间内,反应物浓度的减少或生成物浓度的增加
D. 可用单位时间内氢离子物质的量浓度的变化来表示氢氧化钠和硫酸的反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向1 L 0.1 mol·L-1 NH4Cl溶液中,不断加入固体NaOH后,NH![]() 与NH3 · H2O的变化趋势如下图所示(不考虑体积变化和氨的挥发),下列说法不正确的是( )
与NH3 · H2O的变化趋势如下图所示(不考虑体积变化和氨的挥发),下列说法不正确的是( )
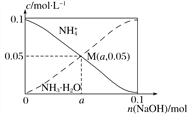
A. 在M点时,n(OH-)-n(H+)=(a-0.05) mol
B. 随着NaOH的加入,![]() 不断增大
不断增大
C. M点溶液中水的电离程度比原溶液小
D. 当n(NaOH)=0.1 mol时,c(OH-)>c(Cl-)-c(NH3·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上产生的氮氧化物可用天然气来处理.
(1)Ⅰ.已知:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1
N2(g)+2O2(g)=2NO2(g)△H2
H2O(l)=H2O(g)△H3
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△ H=(用△ H1、△ H2、△ H3)
(2)Ⅱ.在温度为T1℃和T2℃时,分别将0.50molCH4和1.2molNO2充入体积固定的2L密闭容器中,发生上述可逆反应,测得不同时刻的n(CH4)数据如下表:
温度 | 时间/min | 0 | 10 | 20 | 40 | 50 |
T1℃ | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2℃ | n(CH4) | 0.50 | 0.30 | 0.18 | 0.15 | 0.15 |
①分析上表中数据,下列说法正确的是
A.T1℃ 前10min,V(NO2)=0.03mol/(Lmin)
B.T1℃ 反应达化学平衡状态时,CH4的转化率为80%
C.T2℃ 反应在40min时处于平衡状态
D.T1>T2
②反应的平衡常数K(T1) K(T2),△H0,理由是 .
③T1℃时反应的平衡常数K为 .
④反应在T1℃下进行,50min时,向平衡后的容器中再通入0.10molCH4和0.40molNO2 , 在下图中画出恒温,重新达到平衡过程中n(CH4)随时间变化的曲线(只要求画出n(CH4)的变化趋势,不需要准确画出再次平衡后n(CH4) .
(3)Ⅲ.NO2、O2和熔融NaNO3可制作燃料电池,其原理见下图.该电池在使用过程中石墨Ⅰ电极上生成氧化物Y,其电极反应式为 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下VL氨气溶解在1L水中(水的密度近似为1g/ml),所得溶液的密度为ρ g/ml,质量分数为w,物质浓度为cmol/L,则下列关系中不正确的是( )
A.ρ= ![]()
B.W= ![]()
C.W= ![]()
D.C= ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用乙烯、甲苯、甲基丙烯(E)三种原料合成高分子药物M和有机中间体L的路线如下:
已知:
Ⅲ.L是六元环酯,M分子式是(C15H16O6)n
回答下列问题:
(1)D中含氧官能团的名称是 , B的结构简式是 .
(2)E→F的反应条件是 , H→J的反应类型是 .
(3)F→G的化学反应方程式是 .
(4)K→M属于加聚反应,M的结构简式是 .
(5)在NaOH溶液中,K水解的化学反应方程式是 .
(6)写出3个符合下列条件的C的同分异构体的结构简式 .
①属于芳香族化合物;
②能发生银镜反应;
③核磁共振氢谱有4组峰,且峰面积之比为1:1:2:2.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3═K2O+5Na2O+16N2↑.若氧化产物比还原产物多1.75mol,则下列判断正确的是( )
A.生成44.8LN2(标准状况)
B.有0.250molKNO3被氧化
C.转移电子的物质的量为2.5mol
D.被氧化的N原子的物质的量为0.75mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com