
已知某温度下CH3COOH和NH3·H2O 的电离常数相等,现向10 mL浓度为0.1 mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )
A.水的电离程度始终增大
B.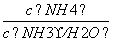 先增大再减小
先增大再减小
C.c(CH3COOH)与c(CH3COO-)之和始终保持不变
D.当加入氨水的体积为10 mL时,c(NH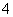 )=c(CH3COO-)
)=c(CH3COO-)
答案 D
解析 A项,醋酸显酸性,水的电离平衡受到抑制,在滴加NH3·H2O的过程中,酸性减弱,水的电离程度受到抑制的程度减小,电离程度增大,当CH3COOH反应完后,加入的NH3·H2O会抑制水的电离,电离程度减小,故该选项错误;B项,在向醋酸中滴加氨水的过程中,碱性增强酸性减弱,c(OH-)一直增大。由NH3·H2ONH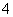 +OH-可知,K=
+OH-可知,K=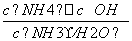 ,则
,则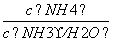 =
= ,而K是常数,故
,而K是常数,故 一直减小,该选项错误;C项,n(CH3COOH)和n(CH3COO-)保持不变,但溶液的体积是增大的,故c(CH3COOH)与c(CH3COO-)之和逐渐减小,该选项错误;D项,当加入氨水10 mL时,两者恰好完全反应生成CH3COONH4,由CH3COOH和NH3·H2O的电离常数相等可知,CH3COO-和NH
一直减小,该选项错误;C项,n(CH3COOH)和n(CH3COO-)保持不变,但溶液的体积是增大的,故c(CH3COOH)与c(CH3COO-)之和逐渐减小,该选项错误;D项,当加入氨水10 mL时,两者恰好完全反应生成CH3COONH4,由CH3COOH和NH3·H2O的电离常数相等可知,CH3COO-和NH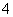 的水解程度也相等,故c(NH
的水解程度也相等,故c(NH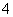 )=c(CH3COO-),该选项正确。
)=c(CH3COO-),该选项正确。


科目:高中化学 来源: 题型:
“碘钟”实验中,3I-+S2O ===I
===I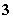 +2SO
+2SO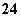 的反应速率可以用I
的反应速率可以用I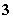 与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,得到的数据如下表:
与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,得到的数据如下表:
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| [I-]/mol·L-1 | 0.040 | 0.080 | 0.080 | 0.160 | 0.120 |
| [S2O | 0.040 | 0.040 | 0.080 | 0.020 | 0.040 |
| t/s | 88.0 | 44.0 | 22.0 | 44.0 | t1 |
回答下列问题:
(1) 该实验的目的是______________________________________________________
________________________________________________________________________。
(2)显色时间t1=________。
(3)温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间t2的范围为__________(填字母)。
A.<22.0 s B.22.0~44.0 s
C.>44.0 s D.数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组在查阅资料时发现:化工厂常用氨气来检验氯气是否泄漏。于是他们设计实验探究氯气与氨气之间的反应。
制备气体的实验装置有(可重复选用):
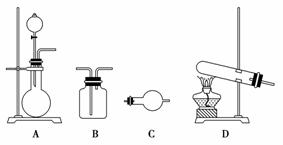
实验药品有:a.MnO2(s) b.浓盐酸 c.浓氨水 d.KClO3(s) e.碱石灰
f.浓硫酸 g.饱和食盐水 h.NaOH(s) i.消石灰
请回答下列问题。
(1)利用上述实验装置与药品制备干燥氨气,应选用的装置有________(填字母序号)。
(2)制取干燥氯气的装置由A、B、B组装而成,则B中应装的试剂依次是________(填字母序号),A中发生反应的化学方程式为__________________________________________________________。
(3)为使氯气、氨气在如图所示装置中充分混合并反应,在a口通入的气体是________,若氨气量较多,则瓶内会出现大量白烟,该白烟为__________________________。
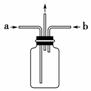
(4)已知,在水溶液中能发生反应3Cl2+2NH3===N2+6HCl,若氯气过量,氯气与氨气反应生成两种化合物,其中一种化合物分子的空间构型与NH3相似,则该反应的化学方程式为__________________________________________________________
__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
体积相同的盐酸和醋酸两种溶液,n(Cl-)=n(CH3COO-)=0.01 mol,下列叙述错误的是( )
A.与NaOH完全中和时,醋酸所消耗的NaOH多
B.分别与足量CaCO3反应时,放出的CO2一样多
C.两种溶液的pH相等
D.分别用水稀释相同倍数时,n(Cl-)<n(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,浓度均为0.1 mol·L-1的6种溶液pH如下:
| 溶质 | Na2CO3 | NaHCO3 | Na2SiO3 | Na2SO3 | NaHSO3 | NaClO |
| pH | 11.6 | 9.7 | 12.3 | 10.0 | 4.0 | 10.3 |
请根据上表数据回答:
(1)常温下,相同物质的量浓度的下列稀溶液,其酸性由强到弱的顺序是__________(用A、B、C表示)。
A.H2SiO3 B.H2SO3 C.H2CO3
(2)在上述NaHCO3溶液中加0.1 mol·L-1CaCl2,不能产生CaCO3沉淀的原因:________________________________________________________________________。
(3)6种溶液中,水的电离程度最小的是________(填化学式)。
(4)若增大氯水中次氯酸的浓度,可向氯水中加入上表中的物质是________(填化学式)。
(5)等浓度的H2SO3和NaHSO3混合液,加入少量的强酸或强碱溶液,pH值都没有明显变化,请解释之。(用离子方程式表示)_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知温度T时水的离子积常数为Kw,该温度下,将浓度为a mol·L-1的一元酸HA与b mol·L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是( )
A.a=b
B.混合溶液的pH=7
C.混合溶液中,c(H+)=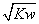 mol·L-1
mol·L-1
D.混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关电解质溶液中粒子浓度关系正确的是( )
A.pH=1的NaHSO4溶液:c(H+)=c(SO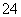 )+c(OH-)
)+c(OH-)
B.含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl-)=c(I-)
C.CO2的水溶液:c(H+)>c(HCO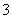 )=2c(CO
)=2c(CO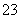 )
)
D.含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O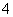 )+c(C2O
)+c(C2O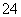 )+c(H2C2O4)]
)+c(H2C2O4)]
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组探究强碱和不同的酸的中和反应,过程如下:
(1)实验步骤:
①分别配制浓度均为0.1 mol·L-1的NaOH、HCl、CH3COOH溶液备用。配制过程中用到的玻璃仪器有量筒、烧杯、容量瓶、玻璃棒、细口瓶、__________。
②在锥形瓶中加入10 mL 0.1 mol·L-1的HCl溶液,在25.00 mL________(填“酸式”或“碱式”)滴定管中加入0.1 mol·L-1的NaOH溶液,连接数据采集器和pH传感器。
③向锥形瓶中滴入NaOH溶液,接近估算的NaOH溶液用量附近时,减慢滴加速度,等读数稳定后,再滴下一滴NaOH溶液。
④利用计算机绘制pH变化图。
用0.1 mol·L-1的CH3COOH溶液代替HCl溶液重复上述②~④的实验操作。
(2)结果分析:
20 ℃时,用NaOH溶液分别滴定HCl、CH3COOH溶液的pH变化曲线如下。

根据上述曲线回答下列问题:
①测得醋酸起点pH为3,则20 ℃时该浓度醋酸的电离度为______________;
②滴定开始后醋酸pH变化比盐酸快的原因是____________________________;
③盐酸恰好完全反应时pH=7,而醋酸恰好完全反应时pH在8左右的原因是________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
判断下列说法是否正确,正确的打“√”,错误的打“×”
(1)化合物既可分为酸、碱、盐、氧化物,又可分为电解质和非电解质( )
(2)非金属氧化物不一定是酸性氧化物,但酸性氧化物一定是非金属氧化物( )
(3)Al2O3可与盐酸和氢氧化钠反应,SiO2可与氢氟酸和氢氧化钠反应,因而二者均属于两性氧化物( )
(4)KHCO3的水溶溶呈碱性,是碱式盐;NaHSO4的水溶液呈酸性,是酸式盐( )
(5)Na2O2、SO2、CH3COOH等为共价化合物;H2SO4、NaOH、Na2CO3等为离子化合物( )
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com