
分析 (1)配制90mL 0.8mol/L的稀盐酸,需要100mL容量瓶,在烧杯中稀释、冷却后转移到容量瓶中定容;
(2)浓盐酸的c=$\frac{1000ρV}{M}$,V×$\frac{1000ρV}{M}$=0.1L×0.8mol/L;
(3)所配制的稀盐酸进行测定,发现浓度大于0.8mol/L,结合c=$\frac{n}{V}$可知,n偏大或V偏小.
解答 解:(1)配制90mL 0.8mol/L的稀盐酸,需要100mL容量瓶,在烧杯中稀释、冷却后转移到容量瓶中定容,则需要使用的仪器有①③⑤⑥,还缺少100 mL容量瓶,
故答案为:①③⑤⑥;100 mL容量瓶;
(2)c=$\frac{1000×1.2×36.5%}{36.5}$=12.0mol/L,V×12.0mol/L=0.1L×0.8mol/L,解得V=6.7mL,量取浓盐酸时应选用量筒的规格为①,
故答案为:12.0mol/L;6.7;①;
(3)配制过程中可能引起浓度偏高的原因为量取浓盐酸时体积偏大、定容时俯视刻度线,
故答案为:量取浓盐酸时体积偏大;定容时俯视刻度线.
点评 本题考查配制一定浓度的溶液,为高频考点,把握配制溶液需要的仪器、步骤、误差分析及计算为解答的关键,侧重分析与应用能力的考查,注意计算公式的应用,题目难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某同学Cr2O72-(aq)+H2O(l)?2CrO42-(aq)+2H+(aq)△H=+13.8kJ/mol
某同学Cr2O72-(aq)+H2O(l)?2CrO42-(aq)+2H+(aq)△H=+13.8kJ/mol| A. | 该反应是一个氧化还原反应 | |
| B. | 待试管b中溶液颜色不变的目的是使Cr2O72-完全反应 | |
| C. | 该实验不能证明减小生成物浓度,平衡正向移动 | |
| D. | 试管c中的现象说明影响平衡的主要因素是温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

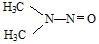 所示,1molNDMA分子中含有σ键的数目为10mol.
所示,1molNDMA分子中含有σ键的数目为10mol.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 发生化学反应时失去电子越多的金属原子,还原能力越强 | |
| B. | NaCl只有在水溶液中才能电离出Na+、Cl- | |
| C. | 能与酸反应的氧化物,不一定是碱性氧化物 | |
| D. | 电离时能产生H+的化合物是酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2的电子式: | B. | Cl原子的结构示意图: | ||
| C. | HClO分子的结构式:H-Cl-O | D. | 乙烯的结构简式:CH2CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 药名 | 胃舒平 | 达喜 |
| 有效成分的化学式 | Al(OH)3 | Al2Mg6(OH)16CO3•4H2O |
| 相对分子质量 | 78 | 530 |
| 每片含有效成分的药量 | 0.245g | 0.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
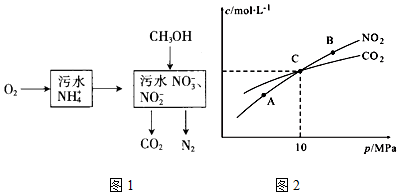
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com