
分析 ①在氧化还原反应中,氧化剂被还原,还原剂被氧化,根据元素的化合价变化分析;
②反应中Cu的价态由+2→+1(还原),11molP元素中6mol化合价升高(氧化)、5mol化合价降低(还原),可见被氧化的6molP,是被Cu(+2)和另一部分P共同氧化的.再分析电子得失数目发现,6mol被氧化的P共失电子30mol,其中Cu(+2)得15mol,另一部分P得另15mol.即15molCuSO4所氧化的P为3mol,则1molCuSO4氧化P$\frac{1}{5}$mol.
解答 解:①在反应11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中,作氧化剂的P的计量数是5,作还原剂的P的计量数是6,氧化剂被还原、还原剂被氧化,所以被氧化的P和被还原的P的物质的量之比为6:5,
故答案为:6:5;
②首先分析反应中各元素的化合价变化,Cu的价态由+2→+1(还原),11molP元素中6mol化合价升高(氧化)、5mol化合价降低(还原),可见被氧化的6molP,是被Cu(+2)和另一部分P共同氧化的.
由电子得失数目可知,6mol被氧化的P共失电子6mol×5=30mol,其中Cu(+2)得15mol,另一部分P得另15mol.则7.5molCuSO4所氧化的P为$\frac{7.5mol}{5}$=1.5mol;
故答案为:1.5.
点评 本题以物质之间的反应为载体考查了物质的量的计算、氧化还原反应,根据物质之间的关系和氧化还原反应原理来分析解答,注意反应中部分P和硫酸铜作氧化剂,为易错点,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该氧原子的摩尔质量为$\frac{12b}{a}$g/mol | B. | 1 mol 该氧原子质量为幽a NAg | ||
| C. | xg 该氧原子所含的电子数为$\frac{16x}{a}$ | D. | yg 该氧原子的中子数一定为$\frac{8y}{a}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
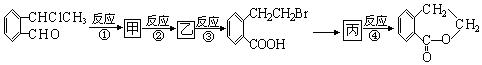
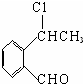 +O2$\stackrel{催化剂}{→}$2
+O2$\stackrel{催化剂}{→}$2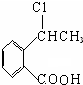 ,氧化反应.
,氧化反应. +NaOH$→_{△}^{CH_{3}CH_{2}OH}$
+NaOH$→_{△}^{CH_{3}CH_{2}OH}$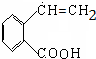 +NaCl+H2O,消去反应.
+NaCl+H2O,消去反应. →丙实际需要两步才能完成,写出第一步反应的化学方程式
→丙实际需要两步才能完成,写出第一步反应的化学方程式 +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$ +NaBr+H2O,第二步所用试剂及目的是试剂是盐酸,目的是将钠盐酸化生成对应的酸.
+NaBr+H2O,第二步所用试剂及目的是试剂是盐酸,目的是将钠盐酸化生成对应的酸.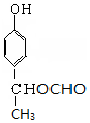 和
和 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
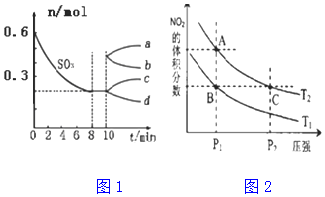
| A. | x+y<z | B. | B的转化率降低 | ||
| C. | 平衡向正反应方向移动 | D. | C的体积分数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在该反应条件下,Mg的还原性强于C的还原性 | |
| B. | Mg、MgO中镁元素微粒的半径:r(Mg2+)<r(Mg) | |
| C. | 元素C 在自然界中既有游离态又有化合态 | |
| D. | 该反应中化学能全部转化为热能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
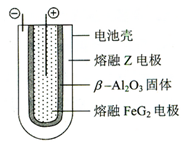 X、Y、Z、M、G五种主族元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.请回答下列问题:
X、Y、Z、M、G五种主族元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.请回答下列问题: .
. 2Z+FeG2放电时,电池的正极反应式为Fe2++2e-=Fe:充电时,钠(写物质名称)电极接电源的负极.
2Z+FeG2放电时,电池的正极反应式为Fe2++2e-=Fe:充电时,钠(写物质名称)电极接电源的负极.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com