
| A. | 若溶液pH=7,则c(A-)=c(HA) | |
| B. | 若c(A-)>c(HA),则溶液中水电离的c(H+)<1.0×10-7mol/L | |
| C. | 若pH>7,加水稀释c(A-)/c(HA)增大 | |
| D. | 溶液中,c(A-)=2c(H+)+c(HA)-2c(OH-) |
分析 常温下,向20mL 0.1mol/LHA(一种弱酸)溶液中加入10mL 0.1mol/LNaOH溶液,充分反应后得到等浓度的HA和NaA混合溶液,
A.溶液中存在电荷守恒分析判断选项,阴阳离子所带电荷总数相同;
B.若c(A-)>c(HA),说明溶液中HA电离程度大于A-离子水解程度,溶液显酸性抑制水的电离;
C.若pH>7说明A-离子水解程度大于HA的电离,c(A-)<c(HA),加水稀释水解程度促进大;
D.溶液中电荷守恒和物料守恒计算分析判断.
解答 解:常温下,向20mL 0.1mol/LHA(一种弱酸)溶液中加入10mL 0.1mol/LNaOH溶液,充分反应后得到等浓度的HA和NaA混合溶液,
A.溶液中阴阳离子所带电荷总数相同,c(H+)+c(Na+)=c(A-)+c(OH-),若溶液pH=7,则c(A-)=c(HA),故A正确;
B.若c(A-)>c(HA),说明溶液中HA电离程度大于A-离子水解程度,溶液显酸性抑制水的电离,则溶液中水电离的c(H+)<1.0×10-7mol/L,故B正确;
C.若pH>7说明A-离子水解程度大于HA的电离,c(A-)<c(HA),加水稀释水解程度促进大,$\frac{c({A}^{-})}{c(HA)}$减小,故C错误;
D.溶液中电荷守恒,c(H+)+c(Na+)=c(A-)+c(OH-),物料守恒:2c(Na+)=c(A-)+c(HA),消去钠离子得到c(A-)=2c(H+)+c(HA)-2c(OH-),故D正确;
故选C.
点评 本题考查了电解质溶液中离子浓度大小比较,主要是电解质溶液中电荷守恒、物料守恒、质子守恒的离子浓度关系的分析原因,掌握基础是解题关键,题目难度中等.


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:选择题
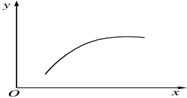 在一密闭容器中通入A、B两种气体,在一定条件下发生反应2A(g)+B(g)?2C(g)△H<0,当反应达到平衡后,改变一个条件(x),下表中量(y)一定符合图中曲线的是( )
在一密闭容器中通入A、B两种气体,在一定条件下发生反应2A(g)+B(g)?2C(g)△H<0,当反应达到平衡后,改变一个条件(x),下表中量(y)一定符合图中曲线的是( )| 选项 | x | y |
| A | 温度 | 混合气体的平均相对分子质量 |
| B | 压强 | A的百分含量 |
| C | 再通入A | B的转化率 |
| D | 加入催化剂 | A的质量分数 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 操作 | 现象 |
| 向盛有4g CaO2的大试管中加入10mL稀盐酸的溶液a | 剧烈反应,产生能使带火星木条复燃的气体 |
| 取5mL溶液a于试管中,滴入两滴石蕊 | 溶液变红,一段时间后溶液颜色明显变浅,稍后,溶液变为无色 |
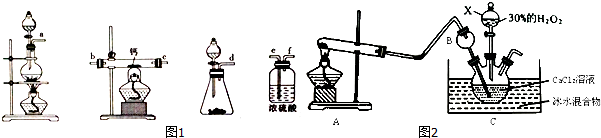
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中只存在2种化合物的分子 | |
| B. | 通入CO2时溶液的漂白作用减弱 | |
| C. | 该溶液中A13+、Fe2+、SO42-、NO3-可以大量共存 | |
| D. | 与SO2反应的离子方程式为Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2可用于加工食品,使食品增白 | |
| B. | NaOH可用于清洗抽油烟机 | |
| C. | 葡萄糖可用于合成保健药物维生素C | |
| D. | 聚丙烯塑料可用作食品保鲜膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去CO2中少量SO2气体,可将气体通过饱和碳酸氢钠溶液洗气 | |
| B. | 除去乙醇中含有的少量水,可加入生石灰,然后进行蒸馏 | |
| C. | 滴定管使用前需要检漏,装溶液时需要润洗 | |
| D. | 除去乙酸乙酯中的少量乙酸,可加入饱和碳酸钠溶液除去乙酸,再进行蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
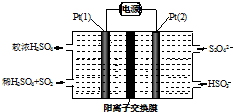 工业尾气SO2有多种吸收和处理方法.
工业尾气SO2有多种吸收和处理方法.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
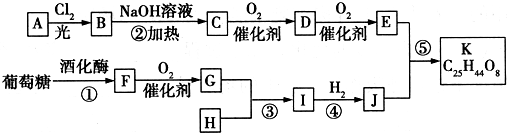
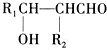
 ;G:CH3CHO.
;G:CH3CHO.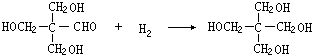 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
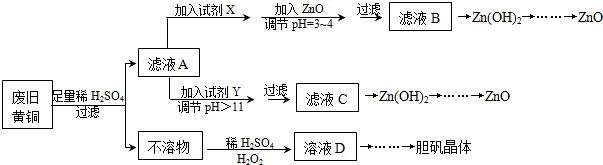
| Fe3+ | Fe2+ | Zn2+ | |
| 开始沉淀的pH | 1.1 | 5.8 | 5.9 |
| 沉淀完全的pH | 3.0 | 8.8 | 8.9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com