
| A、与水或酸反应置换氢气的难易 |
| B、金属性的强弱 |
| C、熔点 |
| D、电子层数 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、Fe2+、Cu2+ |
| B、Cu2+、Zn2+ |
| C、Zn2+、Fe2+ |
| D、Zn2+、Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 |
| B、由C(石墨)→C(金刚石)△H=+1.9 KJ/mol可知,金刚石比石墨稳定 |
| C、1mol H2在足量Cl2中燃烧放热183KJ,则H2的燃烧热为183KJ |
| D、在稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,整个过程放出的热量大于57.3 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3CH2CH2CH2CH2CH3 |
B、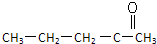 |
| C、CH2═CH-CH═CH2 |
| D、(CH3)3C-C≡C-CH=CHCH3CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、温室效应--二氧化碳 |
| B、光化学污染--二氧化氮 |
| C、酸雨--二氧化碳 |
| D、臭氧层破坏--氟氯烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、试管塞越来越紧,是因为反应消耗了大量O2 |
| B、打开试管塞前Cu元素的化合价为+1价 |
| C、溶液迅速变为蓝色溶液,是因为反应生成了[Cu(H2O)4]2+ |
| D、上述反应原理可用于测定O2的含量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com