

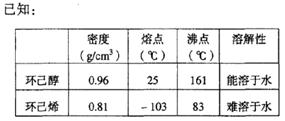
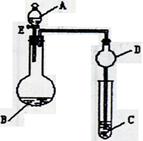
 口进入。蒸馏时要加入生石灰,目的是 。
口进入。蒸馏时要加入生石灰,目的是 。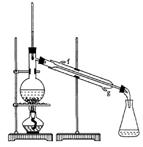
科目:高中化学 来源:不详 题型:实验题
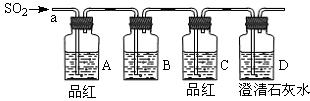
| A.NaCl溶液 | B.酸性KMnO4溶液 | C.盐酸 | D.澄清石灰水 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
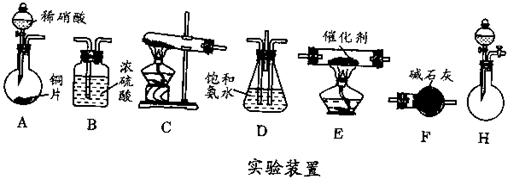
 口或橡皮管均已略去)完成该实验,若气体流向为从左到右,则正确的连接顺序是:
口或橡皮管均已略去)完成该实验,若气体流向为从左到右,则正确的连接顺序是: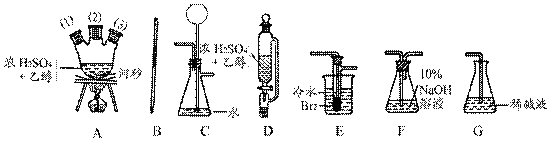
 ____________________。
____________________。 验,反应结束后,测其实验前后的质量,由此得到乙烯产量。
验,反应结束后,测其实验前后的质量,由此得到乙烯产量。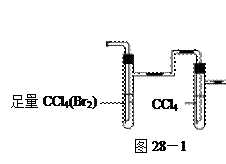 方案II:将E及其后面的装置拆除后,连接图28—2所示装置进行实验,反应结束后,测得乙烯的体积,由此算得乙烯产量。
方案II:将E及其后面的装置拆除后,连接图28—2所示装置进行实验,反应结束后,测得乙烯的体积,由此算得乙烯产量。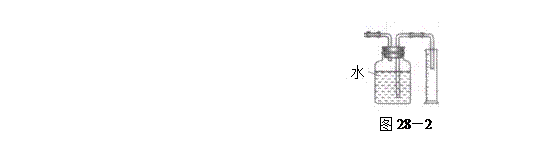
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
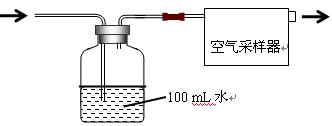
| 环境温度/℃ | 5 | 10 | 15 | 20 | 25 | 30 | 35 |
| 显色时间/min | 45 | 30 | 15 | 13 | 10 | 7 | 5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
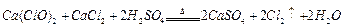 。某学习小组利用此原理设
。某学习小组利用此原理设 计如图所示装置制取氯气并探究其性质。
计如图所示装置制取氯气并探究其性质。
|

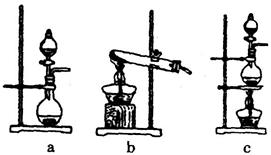 ②乙装置中FeCl2溶液Cl2反应的离子方程式是 。证明FeCl2与Cl2发生了氧化还原反应的实验方法是(填
②乙装置中FeCl2溶液Cl2反应的离子方程式是 。证明FeCl2与Cl2发生了氧化还原反应的实验方法是(填 加试剂的名称、至少填二种)方法 、
加试剂的名称、至少填二种)方法 、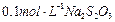 溶液:
溶液: ,共消耗20mLNa2S2O3溶液,则漂白粉中Ca(ClO)2的质量分数为 。
,共消耗20mLNa2S2O3溶液,则漂白粉中Ca(ClO)2的质量分数为 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 _____________。
_____________。
| 试剂组合序号 | 固体试剂/g | NH3体积/mL |
| a | 12.0g Ca(OH)2(过量) 10.8g NH4Cl | 2688 |
| b | 12.0g Ca (OH)2(过量) 10.8g(NH4)2SO4 (OH)2(过量) 10.8g(NH4)2SO4 | 2728 |
| c | 12.0g NaOH(过量) 10.8g NH4Cl | 3136 |
| d | 12.0g NaOH(过量) 10.8g (NH4)2SO4 | 3118 |
| e | 12.0g CaO(过量) 10.8g NH4Cl | 3506 |
| f | 12.0g CaO(过量) 10.8g (NH4)2SO4 | 3584 |
 ____________。
____________。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com