
���� ��1�����ݷ�Ӧ����ʽ��֪���������ӵ�����Ϊ����̼������������m=��V�������Ӧ����̼������������������ʵ����������ݷ�Ӧ����ʽ����Ӧ���ʱ���ʽ�������H2O��ʾ0��5miin��ƽ����Ӧ���ʣ�
��2�����淴Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ�����ֵ�Ũ�ȡ��ٷֺ������ٱ仯���ݴ˽����жϣ�
��3������Ӱ�컯ѧ��Ӧ���ʵ����ػ�������Ӧ���ʱ仯�����ߣ�
��4����CO��g����CH3OH��l����ȼ���ȡ�H�ֱ�Ϊ-283.0kJ•mol-1��-725.8kJ•mol-1��ˮ��Ħ��������Ϊ44.0 kJ/mol����
��CO��g��+$\frac{1}{2}$O2��g��=CO2��g����H=-283.0kJ•mol-1
��CH3OH��l��+$\frac{3}{2}$O2��g��=CO2��g��+2 H2O��l����H=-725.8kJ•mol-1
��H2O��l��=H2O��g����H=-44KJ/mol
�ɸ�˹���ɿ�֪�â�-��+�ۡ�2�õ��Ȼ�ѧ����ʽ��
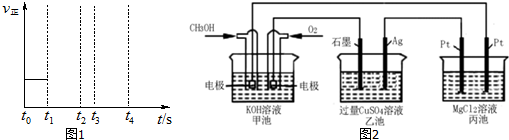
��5��ͼ2�м׳�Ϊԭ��أ�ͨ��״��ĵ缫Ϊ������ͭ�����ĵ缫Ϊ���������ҳ���ʯīΪ��������Ϊ��������Һ��ͭ���������缫�����������������ӵ�Pt�缫Ϊ��������һ���缫Ϊ�����������������ӵ�Pt�缫Ϊ��������һ���缫Ϊ�������缫��ӦΪ������2Cl--2e-=Cl2��������Ϊ2H++2e-=H2����MgCl2+2H2O$\frac{\underline{\;���\;}}{\;}$Mg��OH��2��+H2��+Cl2�����׳��з����ķ�ӦΪ��2CH3OH+3O2+4KOH=2K2CO3+6H2O����Һ�м״���������Ӧ������Һ��������ÿ��Ӧ2mol�״���3mol������Ӧ��Һ��������=2mol��32g/mol+3mol��32g/mol=160g������ת��Ϊ12mol�����׳�������16gʱ������ת��1.2mol�������غ�õ������������ϲ�������Ϊ������þ������
��� �⣺��1�����ݻ�Ϊ3L���ܱ������з���������Ӧ��5min��������������ܶ�������0.12g/L�����ݷ�ӦC��s��+H2O��g��?CO��g��+H2��g����֪���������ӵ�����Ϊ�μӷ�Ӧ�Ĺ���C����������Ӧ����̼�����ʵ���Ϊ��$\frac{0.12g/L��3L}{12g/mol}$=0.03mol���÷�Ӧ����������ˮ�����ʵ���ҲΪ0.03mol������H2O��ʾ0��5miin��ƽ����Ӧ����Ϊ��$\frac{0.03mol}{3L��5min}$=0.002mol/��L•min����
�ʴ�Ϊ��0.002mol/��L•min����
��2��A��CO�ĺ������ֲ�����ƽ���־����A��ȷ��
B����Ӧ����֮�ȵ��ڻ�ѧ����ʽ������֮��Ϊ����Ӧ����֮�ȣ�v����H2O��=v����H2������v����H2��=v����H2������Ӧ�ﵽƽ��״̬��v����H2O��=v����H2��
������˵����Ӧ�ﵽƽ��״̬����B����
C�������������䣬�������ʵ������������л�������ƽ����Է����������ֲ��䣬˵����Ӧ�ﵽƽ��״̬����C��ȷ��
�ʴ�Ϊ��AC��
��3����t1ʱ��С�����������Ӧ��ϵ��ѹǿ�������淴Ӧ���ʶ�����ֱ��t2ʱ���´ﵽƽ�⣻
��t3ʱƽ�ⳣ��K����˵��ƽ�����������ƶ���˵���������¶ȣ�֮������Ӧ������С��ֱ���ﵽ�µ�ƽ�⣬
�������Ϸ���������ͼ��Ϊ��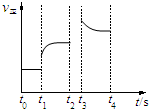 ��
��
�ʴ�Ϊ�� ��
��
��4����CO��g����CH3OH��l����ȼ���ȡ�H�ֱ�Ϊ-283.0kJ•mol-1��-725.8kJ•mol-1����
��CO��g��+$\frac{1}{2}$O2��g��=CO2��g����H=-283.0kJ•mol-1
��CH3OH��l��+$\frac{3}{2}$O2��g��=CO2��g��+2 H2O��l����H=-725.8kJ•mol-1
��H2O��l��=H2O��g����H=-44KJ/mol
�ɸ�˹���ɿ�֪�â�-��+�ۡ�2�÷�ӦCH3OH��l��+O2��g��=CO��g��+2 H2O��g�����÷�Ӧ�ķ�Ӧ�ȡ�H=-725.8kJ•mol-1-��-283.0kJ•mol-1��+2��44KJ/mol=-354.8kJ•mol-1��
�ʴ�Ϊ��CH3OH ��l��+O2��g��=CO ��g��+2H2O ��g����H=-354.8 kJ�Mmol��
��5��ͼ2�м׳�Ϊԭ��أ�ͨ��״��ĵ缫Ϊ������ͭ�����ĵ缫Ϊ���������ҳ���ʯīΪ��������Ϊ��������Һ��ͭ���������缫������Cu2++2e-=Cu�������������������ӷŵ��������������Ե缫��ӦΪ��4OH--4e-=2H2O+O2������ط�Ӧ�����ӷ���ʽΪ��2Cu2++2H2O$\frac{\underline{\;���\;}}{\;}$2Cu+O2+4H+�������������ӵ�Pt�缫Ϊ��������һ���缫Ϊ�������缫��ӦΪ������2Cl--2e-=Cl2��������Ϊ2H++2e-=H2����MgCl2+2H2O$\frac{\underline{\;���\;}}{\;}$Mg��OH��2��+H2��+Cl2�����׳��з����ķ�ӦΪ��2CH3OH+3O2+4KOH=2K2CO3+6H2O����Һ�м״���������Ӧ������Һ��������ÿ��Ӧ2mol�״���3mol������Ӧ��Һ��������=2mol��32g/mol+3mol��32g/mol=160g������ת��Ϊ12mol�����׳�������16gʱ������ת��1.2mol�������غ�õ������������ϲ�������Ϊ������þ�����ݻ�ѧ����ʽ������1mol������þ������ת��2mol���ӣ������ת��1.2mol�����ɳ���������þ0.6mol������õ����ʵ���Ϊ����=0.6mol��58g/mol=34.8g��
�ʴ�Ϊ��2Cu2++2H2O$\frac{\underline{\;���\;}}{\;}$2Cu+O2+4H+��34.8��
���� ���⿼���˻�ѧƽ��ļ��㡢��ѧƽ��״̬���жϡ���ѧƽ���Ӱ�����ء����غ�ԭ���ԭ���ļ����֪ʶ����Ŀ�Ѷ��еȣ���ȷӰ�컯ѧ��Ӧ���ʵ�����Ϊ���ؼ���������ؿ���ѧ���ķ�����������ѧ����������


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | SO2 | B�� | O2 | C�� | Cl2 | D�� | CO2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����³� | B�� | �����³� | C�� | �Ա���ƽ�� | D�� | ���ж� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��0.1mol/L��NaOH��Һ�м���������0.1mol/L��HCl��Һ | |
| B�� | ��0.1mol/L��NaOH��Һ�м���������0.1mol/L��CH3COOH��Һ | |
| C�� | ��0.1mol/L��Ba��OH��2��Һ�м���������0.1mol/L��H2SO4��Һ | |
| D�� | ��0.1mol/L��NH3•H2O��Һ�м���������0.1mol/L��CH3COOH��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 3p2��ʾ3p�ܼ���������� | B�� | ԭ�Ӿ����п��ܴ������Ӽ� | ||
| C�� | ���Ӿ�����һ�����ڹ��ۼ� | D�� | sp2�ӻ����ģ��Ϊ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1mol Na2SO4����ˮ�У�������Һ��Na+����ΪNA | |
| B�� | 18gˮ���е�����Ϊ8NA | |
| C�� | 1L 0.3mol•L-1Na2SO4��Һ�У�����Na+��SO42-����Ϊ0.9NA | |
| D�� | 1���������ӣ�H2��������Ϊ2g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ | B�� | �� | C�� | �� | D�� | �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����BaCl2��Һ�����ɰ�ɫ��������ϡ�����������ʧ����ԭ��Һ��һ����SO42- | |
| B�� | �ýྻ�IJ�˿պȡ��Һ�ڻ��������գ�������ɫ�Ļ��棬��ԭ��Һ��һ������K+ | |
| C�� | ��ij��Һ�м���2��KSCN��Һ����Һ���Ժ�ɫ��������Һ�еμ������Ƶ���ˮ����Һ��Ϊ��ɫ������Һ��һ������Fe2+ | |
| D�� | �����ᣬ���ɵ�������ʹ����ʯ��ˮ����ǣ���ԭ��Һ��һ������CO32- |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com