
【题目】成都七中化学兴趣小组在实验室制备 1,2-二溴乙烷,能使用的药品有乙醇、Br2 的 CCl4溶液以及浓硫酸等。反应装置如下图所示:

有关数据列表如下:

回答下列问题:
(1)用两个化学方程式表示该实验原理:_____________;_________________
(2)用两个化学方程式表示该实验中可能存在的副反应:______________;______________
(3)装置 A 中使用到了恒压滴液漏斗的目的是:_____。装置 B 的目的是:_____________
(4)为保证 D 中尽可能少出现杂质产物,在装置 C 中应加入_____ (填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.酸性 KMnO4 溶液
(5)将 1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在_____层(填“上”、“下”); 若产物中有少量副产物乙醚.可用_____的方法除去;
(6)若产物中有少量未反应的 Br2,最好用_____洗涤除去;(填正确选项前的字母) a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.亚硫酸钠溶液
(7)反应过程中应用冷水冷却装置 D,其主要目的是_____;
【答案】 CH3CH2OH![]() CH2=CH2↑+H2O CH2=CH2+Br2→CH2BrCH2 Br 2C2H5OH
CH2=CH2↑+H2O CH2=CH2+Br2→CH2BrCH2 Br 2C2H5OH![]() C2H5—O—C2H5+H2O C+2H2SO4(浓) ==CO2↑+2SO2↑+2H2O或 C2 H5OH+6H2SO4(浓) == 2 CO2↑+6SO2↑+9H2O 平衡气压,使液体顺利滴下 安全瓶 c 下 蒸馏 d 防止液 Br2 挥发
C2H5—O—C2H5+H2O C+2H2SO4(浓) ==CO2↑+2SO2↑+2H2O或 C2 H5OH+6H2SO4(浓) == 2 CO2↑+6SO2↑+9H2O 平衡气压,使液体顺利滴下 安全瓶 c 下 蒸馏 d 防止液 Br2 挥发
【解析】(1)实验室用乙醇、Br2的CCl4溶液以及浓硫酸等药品制1,2-二溴乙烷,反应原理为:①乙醇在浓硫酸作用下消去反应生成乙烯;②乙烯与Br2发生加成反应。故反应化学方程式为:CH3CH2OH![]() CH2=CH2↑+H2O、CH2=CH2+Br2→CH2BrCH2Br。
CH2=CH2↑+H2O、CH2=CH2+Br2→CH2BrCH2Br。
(2)该反应原理中,乙醇在浓硫酸、140℃时会发生分子间脱水生成乙醚;在温度高于170℃时,和乙醇会被浓硫酸碳化进一步生成CO2等物质。故副反应为:2C2H5OH![]() C2H5—O—C2H5+H2O、C+2H2SO4(浓)
C2H5—O—C2H5+H2O、C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O或C2H5OH+6H2SO4(浓)
CO2↑+2SO2↑+2H2O或C2H5OH+6H2SO4(浓)![]() 2CO2↑+6SO2↑+9H2O。
2CO2↑+6SO2↑+9H2O。
(3)A是制取乙烯的装置,使用恒压滴液漏斗可以保证漏斗和三颈瓶内压强相等,有利于液体顺利滴下;B做安全瓶,平衡气压,防止倒吸。
(4)由于在反应过程中可能生成SO2和CO2,为保证D中尽可能少出现杂质产物,在装置C中应加入氢氧化钠溶液,用来吸收反应中可能生成的酸性气体,防止干扰实验。
(5)由已知,1,2-二溴乙烷的密度比水的大,所以将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层;乙醚的沸点和1,2-二溴乙烷的沸点相差很大,所以产物中有少量副产物乙醚,可用蒸馏的的方法除去。
(6)若1,2-二溴乙烷中混有少量未反应的Br2,a项,Br2在水中溶解度不大,故a不合适;b项,Br2能与氢氧化钠溶液反应,但1,2-二溴乙烷在氢氧化钠溶液中可能水解,故b不是最好;c项,Br2与碘化钠溶液反应生成I2,易溶于有机溶剂,会溶解到1,2-二溴乙烷中,故c不合适;d项,Br2与亚硫酸钠溶液反应从而被除去,并且不影响1,2-二溴乙烷,故d最好。


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】
反应原理:
反应物与产物的物理性质:
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | -103 | 83 | 难溶于水 |
(1)实验过程中可能发生的有机副反应的方程式为________________________________。
(2)根据上述资料,装置__________最适宜用来完成本次制备实验。



A B C
(3)制备粗产品
将5 mL________加入试管A中,再加入l0 mL_______,摇匀后放入碎瓷片,缓慢加热至反应完全。
(4)粗产品提纯
①环己烯粗产品中含有环己醇和少量酸性杂质等。粗产品需依次经过水洗,加碳酸钠溶液洗涤以及第二次水洗。在此过程中加入碳酸钠溶液的目的是_____________;分液时,环己烯应从分液漏斗的_____(填“上”或“下”)口取出。
②向水洗后的环己烯中加入少量的无水氯化钙,再将混合物放入右图所示装置的____________(填仪器名称)中,进行蒸馏,收集产品时,温度计显示的温度应为 。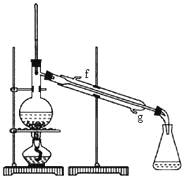
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的性质的叙述中,不正确的是( )
A. 苯是无色、带有特殊气味的液体
B. 常温下苯是不溶于水且密度小于水的液体
C. 苯在一定条件下能与溴发生取代反应
D. 苯不具有典型的双键所应具有的加成反应的性质,故不可能发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雌黄 As2S3 和雄黄 As4S4 都是自然界中常见的砷化物,早期都曾用作绘画颜料,因都有 抗病毒疗效也用来入药。
(1)砷元素有+2、+3 两种常见价态。雄黄在空气中加热至 300℃时会生成两种氧化物,其 中一种氧化物为剧毒的砒霜(As2O3),则物质 a 是_____,可用双氧水将 As2O3 氧化为 H3AsO4,写出该反应的化学方程式:________。

(2)亚砷酸 H3AsO3 可以用于治疗白血病,其在溶液中 存在多种微粒形态,25℃时,各种微粒物质的量分数与 溶液的 pH 关系如图所示。
①人体血液的 pH 在 7.35 ~7.45 之间,用药后人体中 含砷元素的主要微粒是_____。
②下列说法不正确的是_____(填字母序号)。
A.n(H3AsO3):n(H2AsO3-)=1:1 时,溶液显碱性
B.25℃时,H3AsO3 的第一电离平衡常数的值 Ka1=10-5
C.在 K3AsO3 溶液中, c(AsO33-)>c(HAsO32-)>c(H2AsO3-)
③将 KOH 溶液滴人亚砷酸溶液,当 pH 调至 11 时发生反应的离子方程式 是_____。
(3)P 和 As 属于同主族元素,存在亚磷酸(H3PO3),该酸与足量的 NaOH 溶液反应生成Na2HPO3。工业电解 Na2HPO3 溶液可得到亚磷酸,装置示意图如下:

①产品室中反应的离子方程式为_____;
②得到 1mol 亚磷酸的同时,阴极室制得 NaOH 质量为_____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】持续的低温大雪使我国北方地区的“暖宝宝”成为紧俏商品。暖宝宝采用铁的“氧化放热”原理,使其发生原电池反应。已知制作暖宝宝的原料有铁粉、水、活性炭、蛭石、食盐,铁粉在原电池中充当
A.负极 B.正极 C.阴极 D.阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某含锰矿物的主要成分有MnCO3、MnO2、FeCO3、SiO2、Al2O3等。已知FeCO3、MnCO3难溶于水。一种运用阴离子膜电解法的新技术可用于从碳酸锰矿中提取金属锰,主要物质转化关系如下:

(1)设备1中反应后,滤液1里锰元素只以Mn2+的形式存在,且滤渣1中也无MnO2。滤渣1的主要成分是 (填化学式)。
(2)设备1中发生氧化还原反应的离子方程式是 。
(3)设备2中加足量双氧水的作用是 。设计实验方案检验滤液2中是否存在Fe2+: 。
(4)设备4中加入过量氢氧化钠溶液,沉淀部分溶解,。用化学平衡移动原理解释原因: 。
(5)设备3中用阴离子膜法提取金属锰的电解装置图如下:

① 电解装置中箭头表示溶液中阴离子移动的方向,则A电极是直流电源的 极。实际生产中,阳极以稀硫酸为电解液,阳极的电极反应式为 。
② 该工艺之所以采用阴离子交换膜,是为了防止Mn2+进入阳极区发生副反应生成MnO2造成资源浪费,写出该副反应的电极反应式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应H2(g)+ ![]() O2(g)=H2O(g)的能量变化如图所示,a、b、c表示能量变化,为正值,单位为kJ,下列说法正确的是 ( )
O2(g)=H2O(g)的能量变化如图所示,a、b、c表示能量变化,为正值,单位为kJ,下列说法正确的是 ( )

A. H2(g)+ ![]() O2(g)=H2O(g) △H=c kJ·mol-1
O2(g)=H2O(g) △H=c kJ·mol-1
B. 2H2O(g)=2H2 (g)+O2 (g) △H=—2(a-b) kJ·mol-1
C. 1 mol氢气与0.5 mol氧气总能量为akJ
D. 2 mol氢气与1 mol氧气完全反应生成2 mol液态水放出的热量小于2(b-a)kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于胶体的叙述中,不正确的是
A. 用半透膜除去淀粉胶体中的Na+、Cl-
B. 胶体中分散质粒子的直径在1nm~100nm之间
C. 利用丁达尔效应可以区分溶液和胶体
D. 用滤纸能分离胶体和溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为解决能源短缺问题,工业生产中应合理利用化学能。
(1)25 ℃,1.01×105 Pa时,实验测得,4 g氢气在O2中完全燃烧生成液态水,放出572 kJ的热量,则表示H2的燃烧热的热化学方程式为______________________。
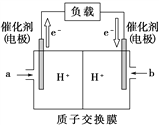
(2)上图是某笔记本电脑使用的甲醇燃料电池的结构示意图。放电时甲醇应从________处通入(填“a”或“b”),电池内部H+向_______(填“左”或“右”)移动。写出电池负极的电极反应式________。正极的电极反应式_______________________。
(3)从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。
化学键 | H—H | N—H | N≡N |
键能/kJ·mol-1 | 436 | a | 945 |
已知:N2(g)+3H2(g)===2NH3(g) ΔH=-93 kJ·mol-1。
试根据表中所列键能数据计算a的数值________。
当可逆反应中净生成N—H物质的量为2mol 时,反应放热_____________。
(4)已知:C(s,石墨)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1 ①
2H2(g)+O2(g)===2H2O(l) ΔH2=-571.6 kJ·mol-1 ②
2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH3=-2599 kJ·mol-1 ③
根据盖斯定律,计算反应2C(s,石墨)+H2(g)===C2H2(g)的ΔH=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com