
| A. | 银氨溶液 | B. | 稀溴水 | C. | 氯化铁溶液 | D. | 氢氧化钠溶液 |
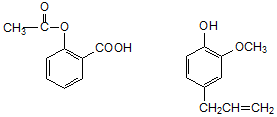
分析 前者含有酯基、羧基,具有酯和羧酸的性质,后者含有酚羟基、醚键和碳碳双键,具有酚、醚和烯烃的性质,以此解答该题.
解答 解:A.二者都不含有醛基,所以都不与银氨溶液反应,所以用银氨溶液无法鉴别,故A错误;
B.前者不含碳碳不饱和键,后者含有碳碳双键和酚羟基,所以前者和溴水不反应,后者能和溴发生加成反应而使稀溴水褪色,可以用稀溴水褪色,所以可以用稀溴水鉴别,故B正确;
C.加入氯化铁,可与酚类物质发生显色反应,可鉴别,故C正确;
D.加入氢氧化钠,前者发生水解、中和反应,后者发生中和反应,没有明显的现象,不能鉴别,故D错误.
故选BC.
点评 本题考查物质的鉴别和检验,为高频考点,把握有机物的官能团与性质及物质检验方法为解答的关键,侧重分析与实验能力的考查,注重元素化合物知识与实验的结合,题目难度不大.


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:实验题
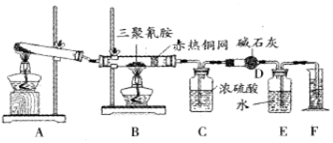
| 仪器 | C | D |
| 实验前 | 101.0g | 56.0g |
| 试验后 | 106.4g | 69.2g |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
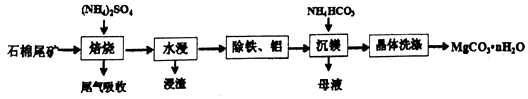
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素符号 | A | B | C | D | E |
| 电负性 | 3.0 | 2.5 | X | 1.5 | 0.9 |
| 原子半径(单位nm) | 0.099 | 0.102 | 0.110 | 0.143 | 0.186 |
| 主要化合价 | -1,+7 | -2,+6 | -3,+5 | +3 | +1 |
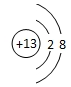 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解熔融的AlCl3生产铝单质 | |
| B. | 将Cl2与HCl混合气体通过饱和食盐水可得到纯净的Cl2 | |
| C. | 用Ba(OH)2溶液可鉴别NaCl、AlCl3、NH4Cl、Na2SO4四种溶液 | |
| D. | 用分液漏斗从食醋中分离出乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 离子组 | X试剂 | 离子方程式 |
| A | K+、Na+、ClO-、SO42- | 少量SO2 | SO2+ClO-+H2O═SO42-+Cl-+2H+ |
| B | NH4+、Fe3+、Br-、SO42- | 过量H2S | 2Fe3++H2S═2Fe2++S↓+2H+ |
| C | NH4+、Na+、Fe3+、[Al(OH)4]- | 过量铜粉 | 2Fe3++Cu═2Fe2++Cu2+ |
| D | K+、Na+、HCO3-、Al3+ | 少量HCl | H++HCO3-═CO2↑+H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.8gNH4+中含有的电子数为NA | |
| B. | 标准状况下,足量Na2O2与22.4LCO2气体充分反应,转移电子数为2NA | |
| C. | 2molSO2和1molO2在一定条件下充分反应,所得混合气体的分子数等于2NA | |
| D. | 298K时,1.0LpH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验步骤 | 实验现象 |
| ①取少量固体于试管中,加入足量蒸馏水 | 得到无色溶液和白色不溶物 |
| ②向上述试管中加入足量稀盐酸 | 有气泡冒出,白色不溶物部分溶解 |
| ③将步骤②所得物过滤,取部分滤液于试管中,向其中加入少量硝酸银溶液 | 有白色沉淀生成 |
| ④另取步骤③所得滤液少许于试管中,向其中加入足量氢氧化钠溶液 | 无明显现象 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com