
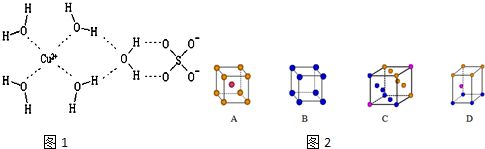
分析 (1)Cu为最密堆积,配位数为12,据此进行判断;
(2)①配离子[Cu(NH3)4]2+中含有配位键,不同非金属元素之间形成极性共价键;
②根据均摊法计算晶胞中Cu、Au原子数目,确定合金中二者原子数目之比;
(3)硫酸铜先和氨水反应生成氢氧化铜沉淀,后氢氧化铜和氨水反应生成络合物;
(4)①形成配位键的条件是中心离子含有空轨道,配体含有孤对电子;
②Fe3+与SCN-以个数比1:1配合所得离子为[Fe(SCN)]2+,据此判断FeCl3与KSCN在水溶液中的反应产物.
解答 解:(1)Cu为最密堆积,其配位数为12,只有C符合,
故答案为:C;
(2)①[Cu(NH3)4]2+中Cu2+与NH3之间的化学键为配位键,N-H为极性共价键,
故答案为:AC;
②铜金合金晶体具有面心立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则晶胞中Cu原子数目=6×$\frac{1}{2}$=3,晶胞中Au原子数目=8×$\frac{1}{8}$=1,故晶胞中Cu原子与Au原子数量之比为3:1,
故答案为:3:1;
(3)氢氧化铜沉淀可以溶于过量的氨水中,反应的离子方程式为:Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH-+4H2O,
故答案为:Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH-+4H2O;
(4)①Fe3+与SCN-反应生成的配合物中,Fe3+提供空轨道,SCN-提供孤对电子,
故答案为:空轨道,孤对电子;
②Fe3+与SCN-以个数比1:1配合所得离子为[Fe(SCN)]2+,所以FeCl3与KSCN在水溶液中反应生成[Fe(SCN)]Cl2与KCl,
故答案为:[Fe(SCN)]Cl2.
点评 本题考查了配合物的成键情况、晶胞的计算、化学键类型判断等知识,题目难度中等,注意掌握配合物成键及其及化学键类型,明确均摊法在晶胞计算中的应用方法.


科目:高中化学 来源: 题型:选择题
| A. | 原子半径大小:Na>P>N | B. | 金属性强弱:K>Na>Ca | ||
| C. | 酸性强弱:H2SiO3>H2CO3 | D. | 碱性强弱:LiOH>NaOH>KOH? |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;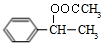 ;
;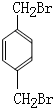 (填结构简式).
(填结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
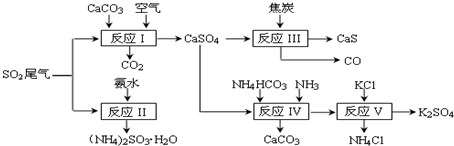
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 乙烯和丙烯 | B. | 甲烷和乙烯 | C. | 甲苯和乙苯 | D. | 乙炔和苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com