
【题目】下列物质中,与甲烷是同系物的是
A.C4H8B.C7H8C.C3H8D.C2H4
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
【题目】阿斯巴甜(F)是一种广泛应用于食品、饮料、糖果的甜味剂,其结构式为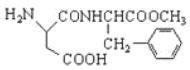 ,合成阿斯巴甜的一种合成路线如下:
,合成阿斯巴甜的一种合成路线如下:
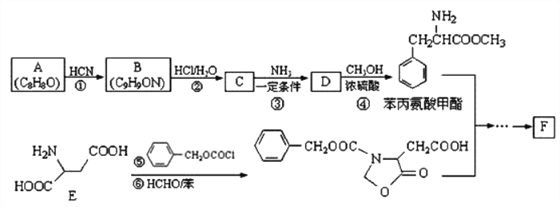
已知:①芳香族化合物A能发生银镜反应,核磁共振氢谱显示有5 种不同化学环境的氢。
②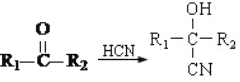
③RCN ![]() RCOOH
RCOOH
④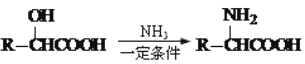
回答下列问题:
(1)A 的名称为_________,E含有的官能团是_____________。
(2)反应①的类型是_________,反应⑤的类型是__________。
(3)C和D的结构简式分别是_______、_________。
(4)C的同分异构体中能同时满足下列条件的共有________种(不考虑立体异构)。
①苯环上有两个取代基
②能与FeCl3 溶液作用显紫色
③能与饱和NaHCO3 溶液反应产生气体
(5)参照上述合成路线,设计一条由甲醛为起始原料制备氨基乙酸的合成路线:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稀土元素是指元素周期表中原子序数为57到71的15种镧系元素,以及与镧系元素化学性质相似的钪(Sc)和钇(Y)共17种元素。稀土元素有“工业维生素”的美称,如今已成为极其重要的战略资源。
(1)钪(Sc)为21号元素,位于周期表的_____区,基态原子价电子排布图为_______。
(2)离子化合物Na3[Sc(OH)6]中,存在的化学键除离子键外还有_______。
(3)Sm(钐)的单质与l,2-二碘乙烷可发生如下反应:Sm +ICH2CH2I→SmI2+CH2=CH2。
ICH2CH2I中碳原子杂化轨道类型为______, lmol CH2=CH2中含有的σ键数目为______。常温下l,2-二碘乙烷为液体而乙烷为气体,其主要原因是__________。
(4) PrO2(二氧化镨)的晶体结构与CaF2相似,晶饱中Pr(镨)原子位于面心和顶点。则PrO2(二氧化镨)的晶胞中有________个氧原子。
(5)Ce(铈)单质为面心立方晶体,其晶胞参数a=516pm。晶胞中Ce(铈)原子的配位数为_______,列式表示Ce(铈)单质的密度:________g/cm3(用NA表示阿伏伽德罗常数的值,不必计算出结果)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 属于糖类、油脂、蛋白质的物质均可发生水解反应
B. 乙酸和乙酸乙酯可用Na2CO3溶液加以区分
C. 室温下,在水中的溶解度:乙酸 >苯酚 >溴乙烷
D. 酚类物质具有还原性,有些可用作食品中的抗氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A是含4碳的多官能团的烃的衍生物,1molA能与2molH2进行加成,A的碳链没有支链,F的分子式为C4H6O2。根据图示填空

(1)化合物A含有的官能团(名称)是____________________________________。
(2)与A具有相同官能团的A的同分异构体的结构简式是________________。
(3)B在酸化后与Br2反应得到D,写出生成D的反应化学方程式__________________。
(4)F的结构用键线式表示是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下浓度为0.1mol/L的几种溶液的pH如右下表。下列有关说法正确的是( )
溶质 | pH |
NaF | 7.5 |
Na2CO3 | 11.6 |
NaClO | 9.7 |
NaHCO3 | 8.3 |
A. 同温度同浓度下,酸由强到弱的顺序为:HF>H2CO3>HClO
B. 水解方程式:F-+H2O![]() HF+OH-的平衡常数为1×10-13
HF+OH-的平衡常数为1×10-13
C. 将CO2通入0.lmol/LNa2CO3溶液至溶液呈中性,则溶液中:2c(CO32-)+c(HCO3-)=0.1mol/L
D. 等物质的量的NaF和HF混合溶液中粒子浓度大小关系为:c(HF)>c(Na+)>c(F-)>c (H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验原理或实验操作正确的是
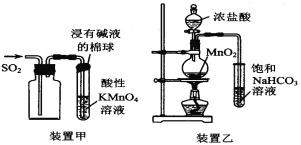
A.用装置甲收集SO2并验证其漂白性
B.用装置乙验证氯气与水反应有盐酸生成
C.用澄清石灰水鉴别苏打溶液和小苏打溶液
D.用NaOH溶液除去苯中混有的少量苯酚,反应后分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气在农业和国防工业都有很重要的作用,历史上诺贝尔化学奖曾经有3次颁给研究氮气与氢气合成氨气的化学家。
(1)下图表示了298K时氮气与氢气合成氨反应过程中的能量变化,据此请回答
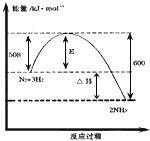
①写出氮气和氢气合成氨的热化学方程式:_____________。
②对于合成氨的反应下列说法正确的是_____________(填编号)。
A.该反应在任意条件下都可以自发进行
B.加入催化剂,能使该反应的E和△H都减小
C.若该反应在298K、398K时的化学平衡常数分别为K1、K2,则K1>K2
D.该反应属于人工固氮
(2)现在普遍应用的工业合成氨的方法为N2+3H2![]() 2NH3,是哈伯于1905年发明的,但此法达到平衡时反应物的转化率不高。
2NH3,是哈伯于1905年发明的,但此法达到平衡时反应物的转化率不高。
①能使该反应的反应速率增大,且平衡向正反应方向移动的措施是_________________。
A.使用的更高效催化剂 B.升高温度
C.及时分离出氨气 D.充入氮气,增大氮气的浓度(保持容器体积不变)
②若在某温度下,2L的密闭容器中发生N2+3H2![]() 2NH3的反应,左下图表示N2的物质的量随时间的变化曲线。用H2表示0~10min内该反应的平均速率v(H2)=_______________。从11min起,压缩容器的体积为1L,则n(N2)的变化曲线为_____________________。
2NH3的反应,左下图表示N2的物质的量随时间的变化曲线。用H2表示0~10min内该反应的平均速率v(H2)=_______________。从11min起,压缩容器的体积为1L,则n(N2)的变化曲线为_____________________。
A. a B.b C.c D.d

(3)随着对合成氨研究的发展,2001年两位希腊化学家提出了电解合成氨的方法,即在常压下把氢气和用氦气稀释的氮气,分别通入一个加热到500℃的电解池中,采用高质子导电性的SCY陶瓷(能传递H+)为介质里,用吸附在它内外表面上的金属钯多晶薄膜作电极,实现了常压、570℃条件下高转化率的电解法合成氮(装置如右上图)。则钯电极上的电极反应式是_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com