
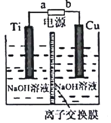
分析 (1)根据盖斯定律结合热化学方程式的书写方法来书写;
(2)采用离子交换膜控制电解液中OH-的浓度,则只有使用阴离子交换膜才能控制氢氧根离子浓度,在电解池的阳极发生失电子的氧化反应;
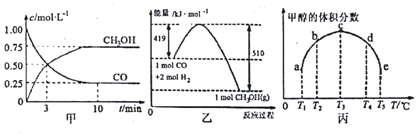
(3)①根据v=$\frac{△c}{△t}$计算v(CH3OH),再根据速率之比等于化学计量数之比计算v(H2);
②使用催化剂能改变反应途径,但不影响平衡移动;
③根据温度对平衡的影响,判断K的变化;
④利用三段式计算平衡时各组分的平衡浓度,再根据k=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$计算;K为生成物浓度幂之积与反应物浓度幂之积的比,结合平衡浓度计算K,结合Qc与K判定平衡移动的方向,进而确定开始时,v(正)、v(逆)的大小;
⑤根据外界条件对平衡的影响分析可知.
解答 解:(1)已知:①2Cu(s)+$\frac{1}{2}$O2(g)═Cu2O(s)△H=-169kJ•mol-1,
②C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5kJ•mol-1,
③2Cu(s)+O2(g)═CuO(s)△H=-314kJ•mol-1
用炭粉在高温条件下还原CuO制取Cu2O和CO的化学方程式为C(s)+2CuO (s)=Cu(s)+CO(g),
该反应可以是②-③-$\frac{1}{2}$×①,反应的焓变是-110.5kJ•mol-1-(-314kJ•mol-1)-$\frac{1}{2}$×(-169kJ•mol-1)=34.5kJ•mol-1,
故答案为:C(s)+2CuO(s)=Cu2O(s)+CO(g)△H=+34.5kJ•mol-1;
(2)采用离子交换膜控制电解液中OH-的浓度,则只有使用阴离子交换膜才能控制氢氧根离子浓度;在电解池中,当阳极是活泼电极时,该电机本身发生失电子得还原反应,在碱性环境下,金属铜失去电子的电极反应为2Cu-2e-+2OH-=Cu2O+H2O,
故答案为:OH-;2Cu-2e-+2OH-=Cu2O+H2O;
(3)①v(CH3OH)=$\frac{0.075mol/L}{10min}$=0.075mol/(L•min),再根据速率之比等于化学计量数之比,故v(H2)=2v(CH3OH)=0.15mol/(L•min),
故答案为:0.15mol/(L•min);
②使用催化剂能降低反应需要的活化能从而改变反应途径,但不影响平衡移动,所以在乙图中画出用Cu2O作催化剂时“反应过程-能量”示意图为: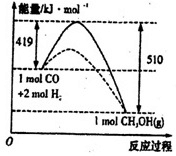
故答案为:
③由丙图可知,T3后为平衡的升温,升高温度时甲醇的体积分数减小,所以,平衡逆移,所以K减小,
故答案为:减小.
④2molCO和6molH2充入2L的密闭容器中,CO、H2的起始浓度分别为$\frac{2mol}{2L}$=1mol/L、$\frac{6mol}{2L}$=3mol/L,充分反应后,达到平衡时测得c(CO)=0.2 mol/L,CO浓度变化为1mol/L-0.2mol/L=0.8mol/L,则:
CO(g)+2H2(g)?CH30H(g)
开始(mol/L):1 3 0
变化(mol/L):0.8 1.6 0.8
平衡(mol/L):0.2 1.4 0.8
故该温度下,该反应的平衡常数k=$\frac{0.8}{0.2×1.{4}^{2}}$=2,
若向该容器中加入4molCO、3molH2、1molCH3OH,
Qc=$\frac{1}{4×{3}^{2}}$=0.0277<2,平衡正向移动,v(正)>v(逆)
故答案为:2;>;
⑤因反应是放热反应和气体体积减小的反应,可采取升温或减小压强可使甲醇体积分数减少,
故答案为:升温或减小压强.
点评 本题考查物质的量浓度随时间变化曲线,涉及化学反应速率及化学平衡、平衡常数的计算,难度中等,注意对基础知识的全面掌握.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 碘是人体必需的微量元素,所以要多吃富含高碘酸的食物 | |
| B. | 生物柴油是不同酯组成的混合物 | |
| C. | 乙酸乙酯和乙醇的混合物可以用分液的方法进行分离 | |
| D. | 工业上通过电解氯化钠溶液制备金属钠和氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,1LpH=13的NaOH溶液中,由水电离的OH-数目为0.1NA | |
| B. | 0.1mol${\;}_{38}^{90}$Sr原子中含中子数为3.8NA | |
| C. | 足量的O2与1molNa充分反应,转移的电子数为NA | |
| D. | 50mL12mol•L-1的盐酸与足量MnO2共热,转移电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的简单氢化物的热稳定性比W强 | |
| B. | Y的简单离子与X的具有相同的电子层结构 | |
| C. | Y与Z形成的化合物的水溶液可使蓝色石蕊试纸变红 | |
| D. | Z与X属于同一主族,与Y属于同一周期 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
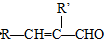 +H2O
+H2O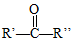 →
→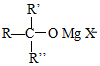 $\stackrel{H+/H_{2}O}{→}$
$\stackrel{H+/H_{2}O}{→}$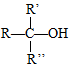

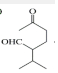 $\stackrel{O{H}^{-}}{→}$
$\stackrel{O{H}^{-}}{→}$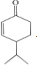 +H2O.
+H2O.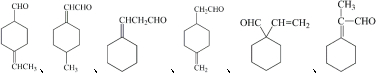
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 待加工铝质工件为阳极 | |
| B. | 可选用不锈钢网作为阴极 | |
| C. | 阴极的电极反应式为:Al3++3e-═Al | |
| D. | 硫酸根离子在电解过程中向阳极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


| 温度/℃ | 30 | 35 | 40 | 45 | 50 |
| TiO2•xH2O转化率/% | 92 | 95 | 97 | 93 | 88 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究发现,在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景.回答下列问题:
研究发现,在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的干馏和石油的分馏都是物理变化 | |
| B. | 1-氯丙烷和2-氯丙烷的消去产物相同 | |
| C. | 正戊烷、异戊烷、新戊烷的沸点逐渐升高 | |
| D. | 除去苯中苯酚,加入溴水后过滤 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com