
| A. | KOH | B. | NaOH | C. | Ba(OH)2 | D. | Mg(OH)2 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
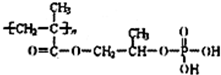
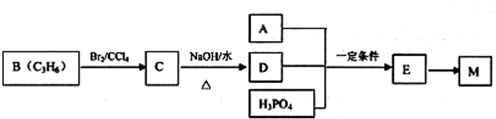
 ,该反应类型是酯化反应.
,该反应类型是酯化反应.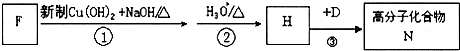
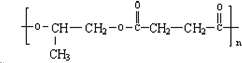
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HBrO3 | B. | XeF2 | C. | HBrO4 | D. | Xe |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | Cl2能与碱反应 | Cl2可用于制漂白粉 |
| B | Si有导电性 | SiO2可用于制光导纤维 |
| C | N2性质稳定 | N2可作为食品保护气 |
| D | 锌的金属性比铁强 | 轮船外壳上焊接若干锌块以减缓其腐蚀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
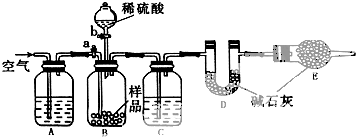
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com