
【题目】高锰酸钾(KMnO4)是一种常用的氧化剂.不同条件下高锰酸钾可发生如下反应:
①MnO4﹣+5e﹣+8H+═Mn2++4H2O
②MnO4﹣+3e﹣+2H2O═MnO2+4OH﹣
③MnO4﹣+e═MnO42﹣(溶液绿色)
(1)从上述三个半反应中可以看出MnO4﹣的还原产物与溶液的有关.
(2)用草酸(H2C2O4)的稀溶液可以洗涤粘在皮肤上的高锰酸钾,其中的变化:H2C2O4→CO2↑.写出该反应的离子方程式: .
(3)将PbO2粉末投入到酸性MnSO4溶液中搅拌,溶液变为紫红色.下列说法正确的是(填字母).
a.氧化性强弱:PbO2>KMnO4
b.还原性强弱:PbO2>KMnO4
c.该反应可以用盐酸酸化
d.PbO2发生还原反应:PbO2+SO42﹣+4H++2e﹣═PbSO4+2H2O
(4)用KMnO4可以测定H2O2溶液的有效含量:取15.00mL某浓度H2O2溶液,逐滴加入0.03mo1L﹣1 KMnO4溶液(已酸化),产生无色气体,至终点时共消耗20.00mL KMnO4溶液.
①写出反应的离子方程式;
②溶液中c(H2O2)=molL﹣1;
③反应中转移电子数目mo1.
【答案】
(1)溶液酸碱性
(2)5H2C2O4+2MnO4﹣+6H+=2Mn2++10CO2↑+8H2O
(3)ad
(4)2MnO4﹣+5H2O2+6H+=2Mn2++5O2↑+8H2O;0.1;0.003
【解析】解:(1)由不同条件下高锰酸钾可发生的反应可知,溶液的酸性越强,反应后锰元素的化合价越低,所以高锰酸根离子(MnO﹣4)反应后的产物与溶液的酸碱性有关,所以答案是:溶液酸碱性;(2)H2C2O4→CO2↑,C化合价升高,则H2C2O4表现还原性并且呈酸性,高锰酸根离子被还原的产物应为Mn2+ , 即发生还原反应的离子反应过程为MnO4﹣→Mn2+ , 所以反应的离子方程式为:5H2C2O4+2MnO4﹣+6H+=2Mn2++10CO2↑+8H2O,所以答案是:5H2C2O4+2MnO4﹣+6H+=2Mn2++10CO2↑+8H2O;(3)将PbO2投入到酸性溶液中搅拌,溶液变为紫红色,证明二者之间发生氧化还原反应生成了高锰酸钾溶液,二氧化铅是氧化剂,硫酸锰是还原剂,
a.氧化剂的氧化性强于氧化产物的氧化性,即氧化性:PbO2>KMnO4 , 故a正确;
b.还原剂的还原性强于还原产物的还原性,即还原性:MnSO4>PbO2 , 得不出还原性:PbO2>KMnO4 , 故b错误;
c、盐酸具有酸性且Cl﹣具有还原性,PbO2能将Cl﹣氧化,所以该反应不能用盐酸酸化,故c错误;
d.二氧化铅是氧化剂,则PbO2发生还原反应生成PbSO4 , 反应式为:PbO2+SO42﹣+4H++2e﹣═PbSO4+2H2O,故d正确;
故选ad;(4)①KMnO4与H2O2反应,有气体产生,说明有氧气,溶液褪色说明KMnO4被还原,再根据电子得失守恒和电荷守恒可写出离子方程式为:2MnO4﹣+5H2O2+6H+=2Mn2++5O2↑+8H2O;
所以答案是:2MnO4﹣+5H2O2+6H+=2Mn2++5O2↑+8H2O;
②根据KMnO4与H2O2反应的离子方程式可知关系式为:
2MnO4﹣~5H2O2
2mol 5mol
0.03molL﹣1×0.02L n(H2O2)
则n(H2O2)=1.5×10﹣3mol
所以c(H2O2)= ![]() =0.1mol/L
=0.1mol/L
所以答案是:0.1mol/L;③由2MnO4﹣+5H2O2+6H+=2Mn2++5O2↑+8H2O,Mn元素化合价从+7降低到+2,所以反应中转移电子数目0.03molL﹣1×0.02L×(7﹣2)
=0.003mol,所以答案是:0.003.


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】下列关于钠的说法不正确的是
A. 金属钠与O2反应,条件不同,产物不同
B. 钠—钾合金通常状况下呈液态,可作原子反应堆的导热剂
C. 钠的化学活泼性很强,少量的钠可保存在煤油中
D. 将金属钠投入水中,生成氢氧化钠,同时放出O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、D、E均为中学化学中的常见物质,它们之间的转化关系如图所示(部分产物略去),则下列有关物质的推断不正确的是( ) 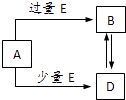
A.若A是铁,则E可能为稀硝酸
B.若A是CuO,E是碳,则B为CO
C.若A是AlCl3溶液,E可能是氨水
D.若A是NaOH溶液,E是CO2 , 则B为NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学利用图1所示实验装置进行NH3的制备、性质等实验. 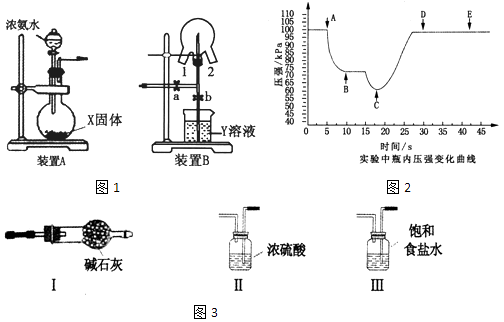
(1)装置A中的烧瓶内的X固体宜选用(填序号).
a.消石灰 b.氯化钙 c.五氧化二磷 d.生石灰
烧瓶中制取NH3的化学方程式为 .
(2)为制取干燥的氨气,可将装置A与下列装置如图3(填序号)进行连接.
(3)装置B可用于探究氯气与氨气的反应.实验时先通过三颈瓶瓶口1通入氨气,然后关闭b活塞,再通过瓶口2通入氯气.
①实验中三颈瓶内出现白烟并在内壁凝结成固体,发生反应的化学方程式为 , 请设计一个实验方案鉴定该固体中的阳离子;
②实验完毕后,观察到三颈瓶内还有黄绿色气体,简述如何处理才能不污染环境 .
(4)可用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理:装置A与装置B相连,打开a,关闭b,开始实验,使三颈瓶内充满NH3 . 将吸有2mL H2O的胶头滴管塞进颈口1,通过颈口2将数据采集器的探头插入三颈瓶中.打开b,关闭a,挤压胶头滴管,进行喷泉实验,电脑绘制三颈瓶内气压变化曲线如图2.该图中点时喷泉最剧烈.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是除去括号内杂质的有关操作,其中正确的是( )
A.乙醇(乙醛)﹣﹣加水,振荡静置后分液
B.乙酸乙酯(乙酸)﹣﹣加乙醇、浓硫酸加热
C.乙烯(乙炔)﹣﹣将气体通过盛KMnO4溶液的洗气瓶
D.苯(苯酚)﹣﹣加足量NaOH溶液,振荡静置后分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.蒸馏可用于分离提纯液态有机混合物
B.乙烯和甲烷可用酸性KMnO4溶液鉴别
C.甲烷和氯气发生取代反应需要光照
D.核磁共振氢谱通常用于分析有机物的相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】开发新能源是解决环境污染的重要举措,其中甲醇、甲烷是优质的清洁燃料,可制作燃料电池. 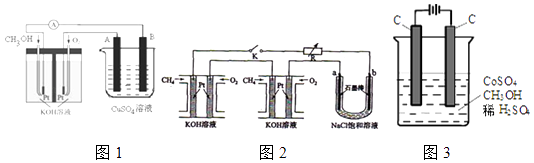
(1)已知:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1=﹣1274.0kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H2=﹣566.0kJ/mol ③H2O(g)=H2O(l)△H3=﹣44kJ/mol. 甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为: .
(2)可利用甲醇燃烧反应设计一个燃料电池.如图1,用Pt作电极材料,用氢氧化钾溶液作电解质溶液,在两个电极上分别充入甲醇和氧气.
①写出燃料电池负极的电极反应式 .
②若利用该燃料电池提供电源,与图2右边烧杯相连,在铁件表面镀铜,则铁件应是极(填”A”或”B”);当铁件的质量增重6.4g时,燃料电池中消耗氧气的标准状况下体积为L.
(3)某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验若每个电池甲烷通入量为1L(标准状况),且反应完全,则理论上通过电解池的电量为(法拉第常数F=9.65×l04C/mol),最多能产生的氯气体积为L(标准状况).
(4)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+ , 然后将甲醇氧化成CO2和H+(用石墨烯除去Co2+)现用如图3所示装置模拟上述过程,则Co2+在阳极的电极反应式为
除去甲醇的离子方程式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com